2019最新盘点:癌症靶向治疗及免疫治疗药物上市!
发布日期:2022-01-27 浏览次数:438
打开2019年最新库存
不知不觉,2019年立秋已经过去,感觉时光飞逝!不经意间,癌症靶向治疗和免疫治疗领域取得了长足的进步。美国作为新药研发大国,不仅批准了新药,还大力拓展已获批准的靶向药物和免疫治疗药物的新适应症。
中国在癌症免疫治疗和靶向治疗方面取得了更加突出的成就。不仅国产新药问世,进口靶向药进入医保的步伐也在进行中。靶向药获批进入医保的速度越来越快,我国自主研发的靶向药也取得了良好的临床疗效。未来,更多靶向药物将进入中国市场,为癌症患者提供新的治疗选择。
今天,化学疗法不再是癌症治疗的首选方法。例如,对于发病率最高的肺癌和乳腺癌,大多数医生会建议进行基因检测,以筛查靶向药物的可用性并评估免疫疗法是否可以受益。靶向治疗和免疫治疗已成为21世纪癌症治疗的中流砥柱。新模式!
目前,国内外获批的靶向药物和免疫治疗药物较多。根据靶点,将国内外已上市或在研的靶点药物分为以下几类,供大家参考。来一些指导值()。
PD-1抑制剂
PD-1(程序性死亡受体-1)主要在活化的T细胞和B细胞中表达,其功能是抑制细胞的活化,这是免疫系统正常的稳态机制,因为过多的T/ B细胞活化会导致自身免疫性疾病,所以PD-1是我们身体的护身符。
然而,肿瘤微环境会诱导浸润性T细胞过表达PD-1分子,肿瘤细胞会过表达PD-1配体PD-L1和PD-L2,导致肿瘤微环境中PD-1通路的持续激活。细胞功能受到抑制,无法杀死肿瘤细胞。
PD-1抑制剂是一种基因工程人源化单克隆抗体,靶向作用于细胞表面的PD-1,可以阻断免疫细胞表面的PD-1和肿瘤细胞表面的PD-L1或PD-L2的结合。 ,解除免疫抑制,恢复免疫功能,进而杀灭肿瘤。
目前国内外上市的PD-1抑制剂有6种,其中3种由国内企业生产。
PD-L1抑制剂
PD-1可在T细胞表面表达,PD-L1在多种肿瘤细胞中表达上调。它与T细胞上的PD-1结合,抑制T细胞增殖和活化,使T细胞失活。,并最终诱导免疫逃逸。
PD-L1抑制剂与肿瘤细胞表面的PD-L1结合,可阻断PD-L1与PD-1的结合。解除免疫限制功能的T细胞可以识别肿瘤细胞并激活它们的攻击和杀伤功能。通过调动人体自身的免疫功能,达到抗肿瘤的效果。
CTLA-4抑制剂
或 CTLA-4(细胞毒性 T 淋巴细胞抗原4),也称为(分化簇 152)),是一种蛋白质受体,可作为免疫检查点并下调免疫反应。是免疫球蛋白超家族的成员由活化的T细胞表达,向T细胞传递抑制信号,可以抑制免疫细胞杀伤肿瘤。
目前唯一获批的CTLA-4抑制剂是,一种与细胞毒性T淋巴细胞抗原结合的重组人单克隆抗体(CTLA-4),阻断CTLA-4与配体相互作用)。恢复T细胞对肿瘤的杀伤作用。而易普利姆玛通常与纳武单抗联合使用。
以上药物都是免疫检查点抑制剂,但也有相应的生物标志物来预测治疗效果。目前广泛使用PD-L1、MSI和TMB。
抗血管生成靶向药物
除了上述免疫检查点抑制剂外,还有另一类单克隆抗体抗癌药,即抑制肿瘤血管生成的药物。然而,此类药物靶向肿瘤细胞表面的单一靶标。例如,帕尼单抗和西妥昔单抗靶向表皮生长因子受体EGFR;贝伐单抗和雷莫芦单抗是人血管内皮生长因子受体拮抗剂。

靶向EGFR
EGFR(表皮生长因子受体)是一种具有酪氨酸激酶活性的跨膜糖蛋白。该通路激活后,影响细胞增殖、分化、信号转导、血管生成、抑制细胞凋亡等,从而诱发癌症。. 通常发生在肺癌中,约 15% 的白种人和 30-50% 的亚洲人有 EGFR 突变。对于没有吸烟史的人来说,这一比例高达50-60%。
EGFR基因常见突变位点出现在外显子18、19、20和21,其中外显子19缺失突变(19)约占45%,外显子21点突变占40%,而这两种突变被称为常见突变(敏感突变)。
EGFR的其他突变(、、、)等称为罕见突变,突变是对二代靶向药物耐药后常发生的突变类型。
EGFR靶向药物治疗非小细胞肺癌
靶向 ALK
该基因最早是在间变性大细胞淋巴瘤中发现的,因此得名ALK(间变性大细胞淋巴瘤激酶)基因。ALK基因可以激活细胞内多条信号通路,从而参与调控细胞生长、转化和抗凋亡的过程。ALK 基因中最常见的致病突变是基因重排,其中 EML4-ALK 是主要的融合。
ALK基因融合常发生在一部分非小细胞肺癌患者中,占5%。ALK突变被称为“钻石突变”,但靶向药物很多,显着增加了治疗的机会。
ALK靶向药物治疗非小细胞肺癌
针对 ROS1
ROS1是一种原癌基因,属于酪氨酸激酶胰岛素受体家族,在多种肿瘤细胞系中高表达。ROS1可以激活与细胞分化、增殖、生长和存活相关的信号通路。当ROS1基因与其他基因融合时,也就是通常意义上的“突变”,就会产生一个新的基因,可以驱动肿瘤生长。发生。
克唑替尼是目前唯一获批用于非小细胞肺癌 ROS1 重排的靶向药物。美国2016年获批,中国2017年获批。在2019版CSCO指南中,克唑替尼在ROS1融合基因阳性IV期一线治疗中获得I类推荐。
此外,还可以靶向 ROS1 的无癌靶向药物 目前正在日本进行审查,作为 ROS1 融合阳性非小细胞肺癌的潜在治疗方法。
ALK靶向药物治疗非小细胞肺癌
目标满足
MET是原癌基因,是多种癌症的驱动基因之一,一般不与肺癌中的EGFR、KRAS、ALK等其他突变共存。MET基因有3种突变类型,即MET外显子14跳跃突变(1%-3%)、原发性MET扩增(1-5%)和罕见的MET融合突变(<1%)。MET 目标目前在 NCCN 指南中被列为克唑替尼的潜在目标。
MET靶向药物治疗非小细胞肺癌
针对 KRAS
KRAS是第一个在人体中发现的致癌基因,但发现了近40年,却一直没有有效的药物,因此一度被称为“不可药性”的基因突变。
KRAS突变一直是癌症患者的祸根。非小细胞肺癌的检出率为13%,结直肠癌的检出率为3%。在所有癌症类型中的检出率为(1-3%)。到目前为止,还没有靶向药物。得到正式认可的。如果在结直肠癌中检测到 KRAS 突变,则禁用西妥昔单抗和帕尼单抗。
在 2019 ACSO 大会上,一款代号为 AMG 510 的靶向药物备受关注,它可以特异性且不可逆地抑制 KRAS G12C 突变。KRAS G12C阳性晚期非小细胞肺癌的缓解率为50%,10例可评价患者中有5例部分缓解,疾病控制率高达100%。
目标 RET
RET是一种原癌基因,与人类各种肿瘤的发生密切相关。RET 融合发生在 1-2% 的非小细胞肺癌中,与肺癌中的其他常见突变(如 ALK、RAS 或 EGFR)不同,具有 RET 突变的患者不会从靶向治疗中受益。化疗通常是唯一的选择,如果患者的病情恶化,选择是有限的。
2018 年 9 月 6 日,FDA 授予研究药物 LOXO-292 用于治疗 RET 突变的非小细胞肺腺癌 () 和甲状腺髓样癌 (MTC) 患者的突破性治疗指定。
2019 年 ASCO 大会公布了 RET 抑制剂 BLU-667 在初治或既往治疗过的晚期 RET 融合非小细胞肺癌患者中的疗效,48 名患者的疾病控制率为 96%,其中许多患者的病情控制时间更长响应的持续时间。
此外,还可以选择、、等多激酶抑制剂进行治疗,但目前还没有针对RET的靶向药物获得正式批准。
靶向HER2
人表皮生长因子受体2(Her-2)是ERBB受体酪氨酸激酶家族的成员。该家族有4个成员,分别是,、和。其中就是大家熟知的EGFR;,也就是Her- 2.
HER2基因突变是乳腺癌和胃癌中常见的致癌驱动基因,在其他肿瘤中也可见到,包括肺癌、卵巢癌、膀胱癌、唾液腺肿瘤、子宫内膜癌、胰腺癌等。
乳腺癌和胃癌HER2靶向药物
针对 BRCA
乳腺癌易感基因(BRCA)是一种重要的抑癌基因,包括和。/2基因是评估乳腺癌、卵巢癌等相关癌症风险的重要生物标志物,也是影响患者选择个体化治疗方案的生物标志物。因此,BRCA检测具有重要的临床意义。
研究表明,有基因突变的人患乳腺癌和卵巢癌的风险分别为50%至85%和15%至45%,而有基因突变的人患乳腺癌和卵巢癌的风险为50%至85%。基因突变。和 10% 到 20%。BRCA 基因突变的乳腺癌和卵巢癌患者可以使用 PARP 抑制剂治疗。此外,PARP抑制剂在小细胞肺癌和胰腺癌的治疗中也取得了良好的临床效果。
卵巢癌、乳腺癌BRCA靶向药物
针对 CDK4/6
CDK4/6抑制剂是近年来兴起的抗癌“神药”,正在迅速改变激素受体(HR)阳性人表皮生长因子受体2(HER2)阴性(HR+,HER2-)的治疗模式晚期乳腺癌。
细胞周期蛋白依赖性激酶 4/6 是一类丝氨酸/苏氨酸激酶,可与细胞周期蛋白 D 结合并调节细胞从 G1 期到 S 期的转变。“-CDK4/6-INK4-Rb通路”异常存在于许多肿瘤中。该通路的改变加速了 G1 期进程,使肿瘤细胞更快地增殖并获得生存优势。因此,其干预成为一种治疗策略,CDK4/6成为抗肿瘤靶点之一。
目前,CDK4/6抑制剂主要在乳腺癌治疗方面取得突破,多种药物也已获批。
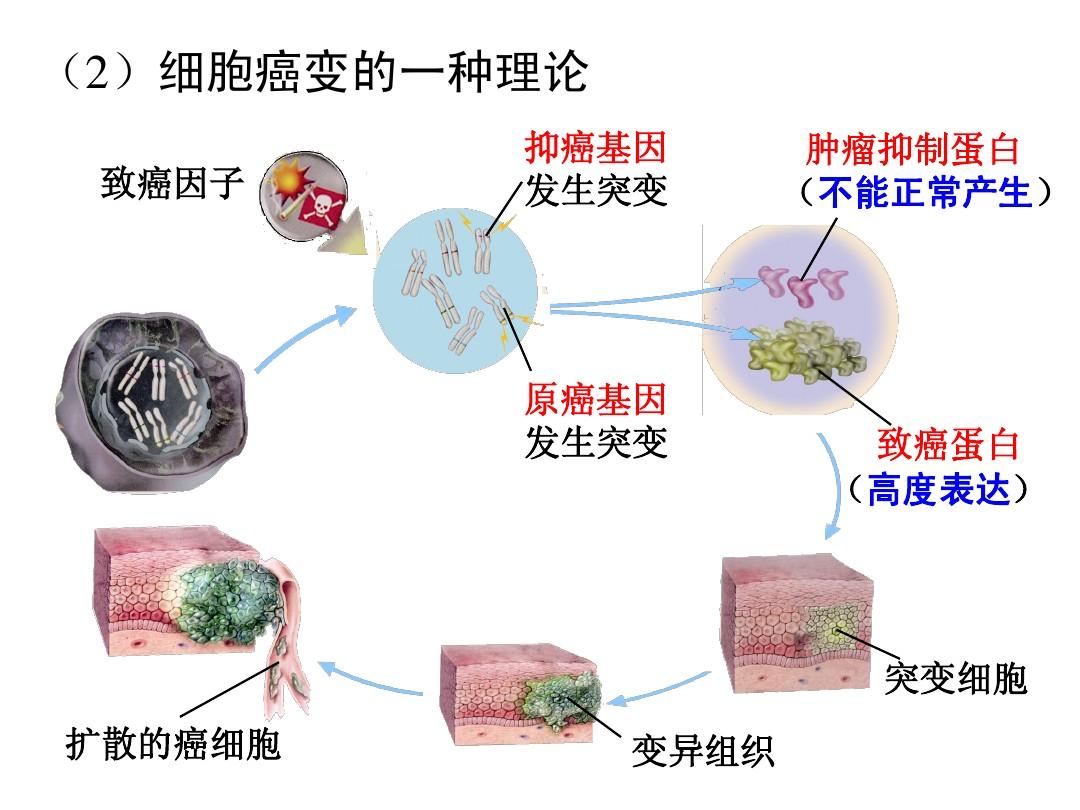
乳腺癌CDK4/6靶向药物
针对 BRAF
BRAF是最重要的人类原癌基因之一,大约8%的人类肿瘤有BRAF突变。它的突变率在黑色素瘤、甲状腺癌、结直肠癌和BRAF中各不相同,而BRAF的大部分突变形式都是突变。这种突变导致下游MEK-ERK信号通路的持续激活,对肿瘤的生长、增殖、侵袭和转移至关重要,是对抗黑色素瘤等突变肿瘤的有效靶点之一。
已发现两种类型的 BRAF 抑制剂,一种是广谱 RAF 激酶抑制剂,它还抑制各种 RAF 亚型和其他激酶,如 KIT 和血管内皮生长因子受体 (VEGF)。主要是以索拉非尼为代表的多靶点激酶抑制剂。另一种是抑制剂,特别是对BRAF有很高的抑制活性。目前,市场上有威罗非尼和达拉非尼。
黑色素瘤的 BRAF 靶向药物
针对 NTRK
虽然 NTRK 基因融合是一种广谱的癌症驱动基因,几乎在所有癌症中都有表达,但它们非常罕见,仅在
TRK融合蛋白是NTRK融合基因异常表达的产物,它将处于持续活跃的状态,触发永久性的信号级联反应,驱动TRK融合肿瘤的扩散和生长。NTRK 融合癌可以发生在身体的任何部位,并且可以发生在所有实体瘤中。虽然发生的概率很低,但一旦检测到融合突变,靶向治疗的有效率是非常高的。
靶向 NTRK——所有实体瘤
多靶点药物
我们上面介绍的许多靶向药物都是针对单一靶点的抗癌药物,而另一种广受好评的靶向多个靶点的药物。优点是可以抑制多种信号通路,具有多种抗肿瘤药物。大大地。多靶点药物治疗可以使药物同时作用于多个靶点,对各个靶点的作用可以产生协同作用,增强抗肿瘤作用。
最著名的是索拉非尼,它是第一个用于肿瘤治疗的多靶点激酶抑制剂。能抑制RAF-1、B-RAF的丝氨酸/苏氨酸激酶活性,并能抑制-2、-3、PDGF-β、KTI、FLT-3等受体有酪氨酸激酶活性,因此具有双重抗肿瘤作用。
随着多靶点药物发现技术的不断成熟,越来越多的多靶点药物进入临床应用以治疗多种不同的癌症。
提醒
以上是小编整理的最常见的靶向药物和免疫治疗药物。篇幅有限,可能有遗漏。我希望做出更多的更正。也可以致电小编,交流靶向治疗和免疫治疗的最新进展以及基因检测的意义。!
看完你想必已经发现,国内药企的很多靶向药和免疫治疗药也已经上市,很多昂贵的靶向药已经进入医保或者捐药保单。受益于国家政策利好,癌症不再可怕!
我们期待更多的药物为癌症患者带来新的治疗选择。我们也相信,随着医学研究的不断进步,随着时间的推移,癌症真的可以成为慢性病,实现“与肿瘤共存”的日子已经不远了!


