欢迎光临吉康旅!
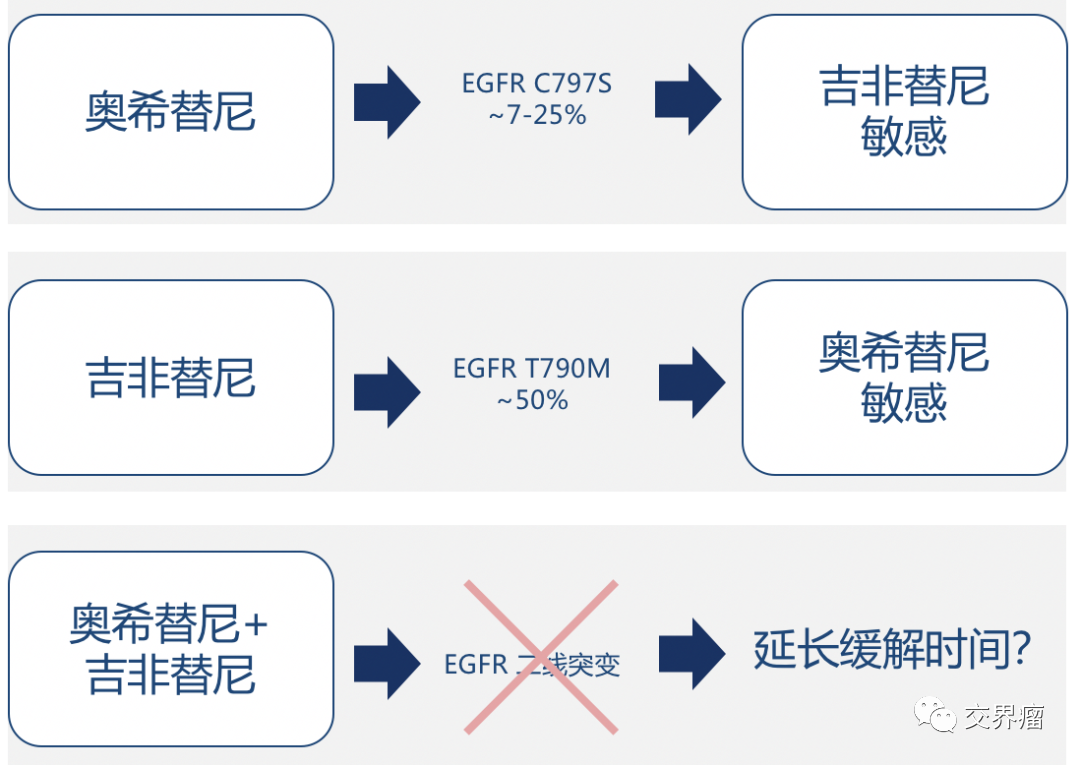
表皮生长因子受体(EGFR)突变是肺癌中最常见的驱动突变,17%-61%的肺腺癌患者有EGFR突变,在亚洲、女性和非吸烟患者中发病率最高。根据最新的III期研究结果,第三代EGFR-TKI奥希替尼已成为EGFR突变患者的首选一线治疗药物,与第一代TKI相比,奥希替尼显着提高了中位PFS(1 8.9 个月 vs 10.2 个月)和中位数 0S(38.6 个月 vs 31.8 个月),CNS 转移控制得到改善。但在一线或二线使用奥希替尼后,难免会出现耐药性。明确奥希替尼的耐药机制,为接受奥希替尼治疗有进展的患者选择下线治疗方案已成为目前的肺癌。治疗的一大挑战。
一.奥希替尼耐药机制
一线治疗耐药机制
研究人员分析了在研究中进展或停止一线奥希替尼治疗的患者血浆样本中检测到的潜在获得性耐药机制。该研究从患者治疗前和疾病进展或停止治疗时获得了配对血浆样本,并进行了下一代测序(NGS),包括来自奥希替尼组91名患者的血浆样本。结果发现:一线奥希替尼治疗取得进展 最常见的获得性耐药机制是停止或停止治疗的患者的 MET 扩增(15%)和 EGFR 突变(7%)。获得性耐药的其他机制包括 HER2 扩增和 RAS 突变。
图1.研究中对奥希替尼一线治疗的耐药机制(SS, et al. 2018 ESMO)
二线治疗耐药机制
在ESMO 2018上,来自美国MD 的研究团队公布了AURA3研究中二线奥希替尼耐药机制的研究结果。在奥希替尼治疗组的 297 名患者中,收集了 83 名患者的血浆样本并进行了突变检测,其中 73 名患者有基线 EGFR 检测结果。在这 73 名患者中,36 名(49%)在疾病进展/治疗停止时未检测到突变,即耐药突变位点丢失,21% 的患者在奥希替尼耐药后出现 EGFR 基因突变,11 名(15%)患有 EGFR -C797 突变; 19% 有 MET 扩增; 5% 有 HER2 扩增;其他获得性耐药机制包括BRAF()、KRAS和突变、融合突变:、RET和NTRK。
图2.研究中对奥希替尼二线治疗的耐药机制(V, et al. 2018 ESMO)
中国人群耐药机制
中国医学科学院北京协和医学院和中国医学科学院肿瘤医院的一项研究在中国人群中招募了 103 名 EGFR 阳性患者,这些患者在第一代 EGFR-TKI 治疗之前和之后都有进展分别使用奥希替尼。进展时取配对血样进行检测,结果显示,30%的患者在进展时有未知的耐药机制,25%的已知耐药机制的患者有EGFR突变(主要是C797和L79) 2),16% MET 扩增,8% TP53 突变,4% KRAS 突变,4% RET 融合,4% 扩增和6.25% RB1 突变。亚组分析显示,与奥希替尼前亚组相比使用亚组中,治疗耐药后MAPK/PI3K信号通路和TP53突变的概率较高。
奥希替尼的一线和二线耐药机制总结如下:
具体来说,奥希替尼耐药机制可分为EGFR依赖性耐药机制和EGFR非依赖性耐药(旁路)激活机制
1)EGFR依赖的耐药机制
EGFR突变是报道最多的第三代EGFR-TKI耐药机制之一。这种耐药性突变靶向奥希替尼 ATP 结合位点的半胱氨酸 797 残基。缺乏共价结合。研究表明,获得性等位基因环境可以预测EGFR-TKI治疗的敏感性。体外研究报道,反式突变对第三代EGFR-TKI有耐药性,但对第一代和第三代TKI的组合敏感,而如果和顺式突变,EGFR-TKI单独或联合作用是无效。
L718 突变是另一种 EGFR 突变,据报道,在 10% 的接受第三代 TKI 治疗的患者中。此外,还发现了其他罕见的点突变:类似的EGFR突变可以在空间上抑制奥希替尼与EGFR的相互作用; L718、L792、G719、G724和外显子20的插入也有文献记载,但均为罕见突变(不到1%的患者)。
2)EGFR 非依赖性耐药机制
MET基因扩增
奥希替尼耐药患者最常见的替代途径是 cMET 扩增。虽然这一发现在第一代或第二代 TKI 后疾病进展的患者中很少见(约 5%),但在 10%-24% 的奥希替尼治疗后疾病进展患者中发现了 MET 拷贝数。 MET基因扩增将继续激活EGFR的下游通路,如由丝裂原活化蛋白激酶(MAPK)、信号转导和转录激活因子(STAT)和磷脂酰肌醇3激酶(PI3K)介导的EGFR激活。与信号传导无关的途径,导致对奥希替尼的获得性耐药。在该研究中,近 19% 的患者在疾病进展或治疗中断时发生 MET 基因扩增
HER-2扩增
细胞中HER-2或MET的过表达可通过ERK和AKT的持续激活导致对奥希替尼的获得性耐药,而细胞系中HER-2的过表达降低细胞对奥希替尼的耐药敏感性。与第一代EGFR-TKI耐药相似,HER-2基因扩增和EGFR突变相互排斥。此外,HER-2基因扩增可以与EGFR突变、突变、基因扩增共存,也可以与EGFR突变和MET基因扩增共存。
RAS-MAPK 绕过激活
RAS-MAPK 通路的激活与 KRAS、BRAF、NRAS、MEK1 基因突变和 KRAS 基因扩增有关。 KRAS 突变包括 G12S、G12A、Q61H、G12D 和 .研究表明,这些突变可导致对奥希替尼的获得性耐药。在临床前模型中使用奥希替尼后,已确定 NRAS E63K 突变或 NRAS 拷贝数增加。在体外,耐药细胞系对MEK抑制剂和EGFR-TKI联合用药的敏感性增强。
其他替代途径:融合变体
目前临床观察到的对奥希替尼融合突变的耐药性包括RET、ALK、BRAF等癌基因。对于这部分耐药机制,基本的治疗策略是联合EGFR抑制剂和融合基因相应的抑制剂。既往回顾性研究报道了联合 BLU-667(RET 抑制剂)、艾乐替尼()或克唑替尼(ALK 抑制剂)、曲美替尼(MEK 抑制剂)来克服融合突变耐药性治疗,然而,在奥希替尼联合曲美替尼的回顾性研究中,毒性非常严重并观察到副作用,提示不同抑制剂的组合应谨慎对待。在临床实践中需要注意的是,基于NGS的检测可能无法完全检测出融合变异体,而应同时结合基于RNA的融合基因检测。
组织表型转化
大约 (5%-10%) 的患者在 EGFR-TKI 治疗期间或之后发生小细胞肺癌 (SCLC) 的组织学转化,这也是奥希替尼耐药的重要原因。研究表明,肿瘤抑制基因 RB1 和 TP53 在向 SCLC 转化过程中完全失活,提示失活的 RB1 和 TP53 基因是组织学转化的潜在诱因。现有证据表明,SCLC 转化患者对铂类和依托泊苷的联合化疗反应良好。最近在奥希替尼一线和二线治疗失败的患者中也观察到组织学转化为鳞状细胞癌。
第二。奥希替尼耐药后的治疗策略
寡转移治疗
对于寡转移患者,选择包括手术切除或放射治疗、局部消融治疗等。前瞻性研究表明,局部干预可显着延长患者复发和进展的时间。 NCCN 指南建议在继续使用奥希替尼的同时,可考虑根治性局部治疗(如立体定向放疗或手术):①无症状进展; ②有症状的脑转移瘤(配合脑转移瘤治疗,如全脑放疗、培美曲塞、替莫唑胺、鞘内注射等); ③有症状的全身(颅外)孤立性病变。但在实际临床治疗中,寡转移患者可能同时出现多个快速进展的病灶,因此临床治疗更倾向于选择替代全身治疗策略。
全身治疗
对于需要改变全身治疗方案的患者,首先需要进行组织再活检以获得组织病理学评价、NGS基因检测信息等,为后续治疗提供决策依据。当无法获得组织时,外周血可作为评价耐药机制的手段,但应考虑潜在的假阴性,需注意外周血不能评价是否存在组织转化介导的耐药性。
EGFR突变
单药第一代或第二代 EGFR-TKI 可用于仅由位点突变介导的耐药性。对于临床上合并的顺式耐药突变,临床前研究和相关病例报告显示,布加替尼Ni()与EGFR单克隆抗体西妥昔单抗()的联合用药可以有效克服这种耐药机制。第三代EGFR-TKI的反式突变并对第三代EGFR-TKI具有抗性,但对第一代和第三代TKI的组合敏感。此外,基于第四代EGFR-TKI的I/II期临床研究也即将启动。
MET扩增
研究表明,奥希替尼联合MET抑制剂在EGFR-TKI治疗进展后患者的ORR为30%,中位缓解持续时间为7.9个月。此外,也有相应的 MET 组合,并且正在研究 队列。 MET/EGFR双特异性抗体JNJ-372在MET扩增患者中也显示出疗效,但能否成为MET/EGFR-TKI联合治疗取得进展后的有效策略还需等待进一步的临床研究数据。
靶向药物选择总结
组织学转化患者的治疗
对于小细胞转化患者,仍推荐EP化疗。一项回顾性研究显示,54%的患者在小细胞转化后对EP治疗有临床反应,中位生存时间为1
从@0.9月至7月1日3.,随后接受单药免疫治疗的17例患者均无效。目前,对于小细胞转化患者,免疫联合化疗是否可行仍需相关临床研究。此外,临床上也观察到部分鳞癌转化介导的EGFR-TKI耐药,但相关研究报道较少。目前建议根据组织学选择更合适的化疗方案。
化疗
研究评估了吉非替尼耐药后标准化疗联合吉非替尼的可行性,结果显示二线吉非替尼联合化疗并未提高无进展生存期(PFS)或总生存期(OS),但在三近期一线吉非替尼联合化疗的III期研究显示OS获益,目前的研究(一线奥希替尼联合化疗)和研究(一线奥希替尼耐药继以化疗联合奥希替尼)仍在进行中 2019年, ASCO 报道了一项关于奥希替尼联合化疗作为二线和后线治疗的回顾性研究。 98% 的患者过去曾接受过奥希替尼治疗。初步数据表明,这种治疗策略是安全可行的。奥希替尼一线耐药后是否可以使用奥希替尼联合化疗仍有待前瞻性研究发表。
免疫疗法
并且该研究招募了少数具有 EGFR 突变的患者。研究表明,()联合化疗和抗血管治疗对既往接受过EGFR-TKI进展的患者是安全有效的,但在化疗联合组中未见获益,研究()联合化疗)在 EGFR 突变患者中也没有显示出益处。还有多项 III 期前瞻性研究评估了 EGFR-TKI 耐药后 EGFR 突变患者的免疫治疗。疗效,这些研究目前正在进行中。既往研究表明,免疫治疗后使用EGFR-TKI可显着增加相关不良反应。一项回顾性研究表明,在免疫治疗 3 个月内接受奥希替尼的患者导致高达 24% 的严重免疫相关不良反应。总体而言,目前免疫治疗对EGFR突变患者无效,且副作用增加,应慎用。
组合模式
面对第三代EGFR TKIs的多重原发性和获得性耐药,奥希替尼联合治疗是一个主要的发展方向。通过TKI或免疫治疗药物的联合用药,延缓或克服耐药性药物,造福更多患者。下图为正在进行的奥希替尼进展后联合治疗临床试验:
作者观点
随着第三代EGFR-TKI临床应用的逐步普及,肺癌的治疗已进入“后三代EGFR药物”时代。如何解决三代耐药后的后续治疗是临床亟待解决的问题。无论作为一线还是二线治疗,奥希替尼的主要耐药突变包括共突变、MET扩增、HER2扩增、RAS-MAPK旁路激活、小细胞转化等。因此,我认为:
疗法提供决策选择。如果能找到耐药突变位点,就可以有针对性地给予上述联合靶向治疗。
一般来说,第三代EGFR-TKI耐药并非无法治愈。只有明确耐药机制,才是帮助患者在临床实践中找到出路的最佳途径。
参考文献
JC、Ohe Y、J 等人。在 egfr- 非细胞肺中。 N Engl J Med 2018;378:113-125.
2Mok TS、Wu YL、Ahn MJ 等人。或 - 在 egfr - 肺。 N Engl J Med 2017;376:629-640.
3 Xing PY, et al.的非细胞肺。临床杂志 2019 年 37 期:,-.
- AJ, LV, Z. 用于 egfr- 肺上:A。临床医学杂志 2020:。
C、L、F 等。 egfr-lung 中的 to-egfr-tkis 。安 2018;29:i28-i37.
S,李JJN,NB。和 。肺 2020;147:123-129
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话