欢迎光临吉康旅!
近年来,ST段抬高型心肌梗死(PCI)患者经皮冠状动脉介入治疗(PCI)后抗凝治疗的益处一直是热门话题。尽管初步研究表明抗栓治疗可以预防缺血再发的风险,但潜在的出血风险可能会抵消其益处,需要进一步研究,而抗栓治疗仍是一个谜。
在此背景下,6月6日,首都医科大学附属北京安贞医院聂少平教授在2022东北心血管病在线论坛上发表了题为“PCI术后抗凝治疗的优缺点”的主题。亮点现在组织如下。
聂教授在报告中表示,中国心血管病医疗质量提升工程数据显示,近5年急性冠脉综合征(ACS)患者大出血发生率降低了1/4,这可能与医院使用抗血栓药物有关。更规范。然后就ACS患者抗凝的原因、ACS患者术后循证抗凝以及ACS患者PCI术后抗凝的临床实践进行了探讨。
一、ACS患者抗凝的原因
(一)血栓事件的原理
由于动脉粥样硬化进展导致动脉粥样硬化血栓形成和缺血(图1),血栓事件的风险很高,抗凝参与ACS治疗的后期(包括不稳定型心绞痛、心肌梗塞)治疗。
图1动脉粥样硬化的进展
1.ACS:在斑块破裂或斑块侵蚀的情况下,血小板的凝血级联和活化形成次全闭塞或闭塞血栓导致事件。
2.慢性冠状动脉综合征:斑块愈合过程中血小板、凝血和炎症通路之间的相互作用是动脉粥样硬化进展和血栓并发症发展的关键。
综上所述,从机制上看,动脉粥样硬化血栓和缺血是由血小板、凝血和炎症相互作用引起的,所以ACS和慢性冠状动脉综合征的治疗需要有针对性,即抗血栓治疗( ) + 抗凝治疗 + 抗炎)。
同时,聂教授详细介绍了ACS血栓形成的机制(图2)——血小板和凝血的双重途径,并指出凝血酶和血小板活化呈正反馈回路。也就是说,凝血酶可以引起血小板活化血小板可以产生凝血酶。
图2 ACS血栓形成机制
注意:a.血小板在暴露于胶原、血管性血友病因子和斑块成分等内皮下结构后被激活(图2左上),形成活化血小板。
b.组织因子激活凝血(图 2 右上角),导致纤维蛋白形成。
c。纤维蛋白与活化的血小板形成坚固的血凝块。
d。纤溶酶原通过触发内源性纤溶来溶解血栓(图2底部)。
另外,由于凝血酶可以参与ACS的病理生理过程(图3),它会促进心肌坏死、炎症和内皮功能障碍,因此单独抗血小板治疗不是ACS患者的选择,并且抗凝治疗尤为重要。
图3凝血酶参与ACS的病理生理过程
(二)ACS抗栓治疗的优势
1.ACS 的急性(短期)抗血栓治疗——病变和干预(图4)
抗血栓治疗可减少与血管壁创伤相关的血栓形成相关的围手术期心肌损伤,例如夹层或斑块破裂、栓塞或侧支闭塞;降低支架内血栓形成的风险,在PCI急性期或亚急性期较为常见。
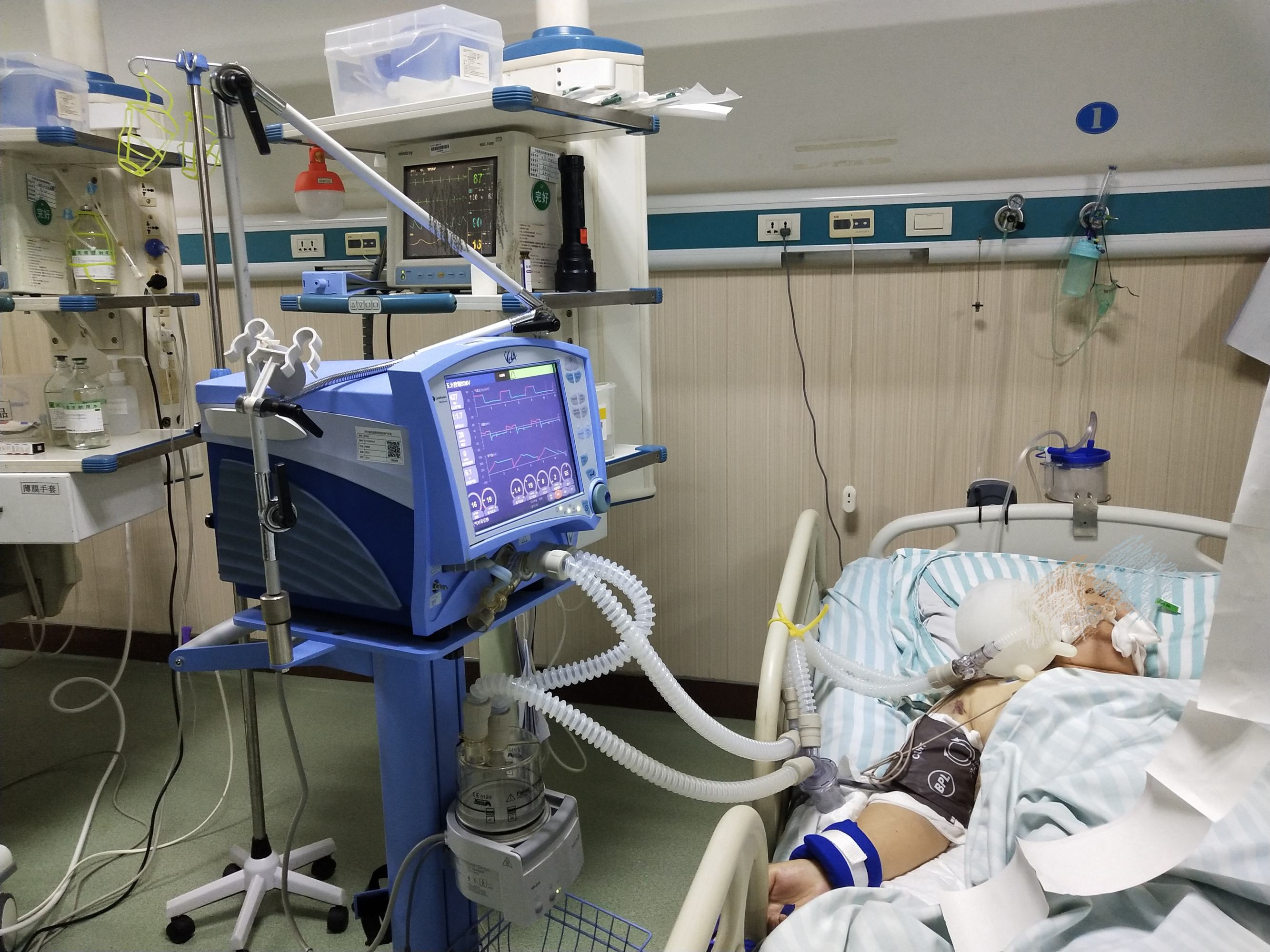
图4 ACS急性期(短期)的抗血栓治疗
2.ACS 的长期抗栓治疗——缺血和出血风险的动态变化(图5)
(1)缺血风险:主要体现在三个方面。①支架内血栓形成/血运重建,1个月内最高,随后逐渐下降至1%水平;②心肌再梗死/心源性死亡,风险逐渐下降1-3个月;③中风或其他动脉粥样硬化疾病的风险逐渐降低。
(2)出血风险:相对稳定,1~3个月逐渐下降,之后维持在5%的水平。
图5 ACS长期抗栓治疗后缺血和出血风险的动态变化
3.ACS不同阶段的血栓风险及抗血栓策略
聂教授通过ACS血栓风险研究报告总结了ACS不同时期的血栓风险及抗栓策略。
(1)ACS后不同阶段,抗栓治疗的重点在不断变化。
(2)在ACS早期和PCI围手术期,重点应放在有效的抗血小板和凝血酶抑制上。
(3)在 ACS 中期(出院或 1 周至前 3 个月),应权衡强化抗血小板治疗的益处与增加的出血风险。
(4)在从 ACS 向慢性冠状动脉综合征的过渡过程中,由于存在临床危险因素以及血小板和凝血酶的持续激活,动脉粥样硬化血栓形成的风险增加并显着超过出血风险。是可控的,长期的抗血栓形成策略可能是有益的。
二、ACS患者术后循证抗凝
(一)ACS患者术后长期使用肠外抗凝剂
临床上,ACS患者PCI术后延长使用肠外抗凝剂(如肝素、低分子肝素、黄大肝葵等)非常普遍(CCC-ACS数据显示,我国延长使用率高达75%)。 %)。但对于无抗凝指征的患者(如房颤、瓣膜置换术后等),现有指南不推荐使用。
2020 年 ESC 指南甚至明确指出,无抗凝指征的非 ST 段抬高 ACS 患者 PCI 后应停用所有抗凝药物。可见,ACS患者长期使用肠外抗凝剂的临床实践与指南存在巨大差距。
聂教授介绍了多项关于ACS患者长期使用肠外抗凝药的研究,包括试验、荟萃分析、试验和试验。
1.试验(图6)是一项国际多中心、开放标签、随机对照试验,涉及910名患者。依诺肝素组和普通肝素组。直接PCI后延长抗凝的数据分析得出结论:依诺肝素显着减少缺血事件而不增加出血风险。
图6实验
2.一项涉及 16 294 名接受直接 PCI 的患者的 5 项临床试验的荟萃分析(图 7) 显示,与肝素组相比,比伐卢定组的 AST 风险增加了 2 倍,并继续使用全剂量比伐卢定可改善出血(RR=0.90, 95%CI0.32~2.54, P=0.85 2);小剂量比伐卢定无改善,另外,与肝素组相比,比伐卢定组30天大出血风险降低47%,术后使用全剂量比伐卢定3~4 h即可降低比伐卢定相关的 AST 并且仍然减少出血。也就是说,即使 PCI 长期使用全剂量比伐卢定组,获益仍然存在 (RR=0.29, 95%CI 0.16~ 0.53,P<0.001).
图 7 元分析
3. 试验(图8) 是一项随机、安慰剂对照试验,纳入 1102 名支架血栓高风险患者(<48 小时,弥漫性远端病变,大块血栓,急性闭塞,残余夹层等),随机给予依诺肝素 40-60 mg,q12h×14 d 或安慰剂。结果显示,15-30 d 缺血事件和可能的支架血栓发生率分别仅为 0.73% 和 73 %,分别为 0.27%。依诺肝素组和安慰剂组的 30 天大出血发生率无显着差异(3.3% vs.1.6% ,P=0.08),依诺肝素组轻微出血发生率高于安慰剂组(25% vs. 5.1%,P=0.001). 总之,依诺肝素对 PCI 后延长(14 天)没有额外的好处。
图 8 实验

4. 试验(图 9) 是一项多中心、开放标签、随机优效性试验,包括 7213 名 ACS 患者,3 次随机分组,第三次随机分组 PCI 后停止输液组结果显示,PCI术后长期使用比伐卢定或依诺肝素组与不使用相比,使用小剂量比伐卢定或依诺肝素全剂量优于伐卢定。
图 9 实验
(二)稳定期使用口服抗凝剂的ACS患者
ACS 发病后 1 个月至 1 年的时期往往是一个中间或稳定时期。大量研究表明,即使在支架植入和药物治疗后,凝血系统的激活在术后 6 个月甚至 1 年仍然存在。在这方面,多项研究(包括 2 试验、-ACS 2-TIMI 51 试验和 ACS 1 试验)评估了在近期 ACS 和有复发性缺血风险的患者中,在抗血小板治疗的基础上联合口服抗凝剂的效果事件。
1. 2 项试验(图 10) 是一项随机、双盲、安慰剂对照研究,对近期患有 ≥2 个其他复发性缺血事件危险因素的 ACS 患者进行研究,他们分为阿哌沙班组和安慰剂组。结果显示,与安慰剂相比,ACS后阿哌沙班无效,同时使用阿司匹林(ASA)或ASA+氯吡格雷,均增加出血。
图 10 2 测试
2.-ACS 2-TIMI 51 试验(图 11),一项对 15 526 名患者的随机对照研究)表明,在近期 ACS 患者中,低剂量利伐沙班降低了复合事件焦点并增加大出血和颅内出血的风险,但不会导致致命性出血。
图 11 - ACS 2-TIMI 51 测试
3. ACS 1 试验(图 12) 是一项在 3000 名近期 ACS 患者使用抑制剂的基础上,比较 ASA 和利伐沙班与长期抗凝治疗的研究)结果显示低-剂量的利伐沙班+抑制剂并不优于ASA+抑制剂,没有明显的益处。同时,利伐沙班并未减少缺血事件的发生,大出血事件的发生率与ASA相当。
p>
图 12 ACS 1
综上所述,对于高缺血风险和低出血风险的 ACS 患者,可在肠外抗凝停药课程后考虑 ASA、氯吡格雷和低剂量(或血管剂量)利伐沙,并建议两者联合决策医生和患者(图 13).
图13详细结论
另外,急性心肌梗死后,前壁心肌梗死后左室壁血栓、左室动脉瘤、冠心病+外周动脉疾病、外周血管疾病等高危患者,在急性期停止肠外注射。阶段抗凝后,联合使用小剂量利伐沙班可能有益。
(三)ACS患者长期长期使用口服抗凝剂
ACS 一年后进入慢性期,部分患者可能仍会从抗凝治疗中获益,例如试验(图 14)。该研究包括 30 多个国家、600 多个研究中心、27 个402 名冠状动脉或外周动脉疾病患者被随机分配接受利伐沙班(2.5 mg,每天两次)+ ASA(100 mg,每天一次)或利伐沙班(2.5 mg,每天两次)一天)伐沙班(5 mg,每天两次)单药治疗,或 ASA(100 mg,每天一次)单药治疗。
结果显示,对于稳定期动脉粥样硬化性血管病患者,长期利伐沙班+ASA组的心血管结局(包括心血管死亡、脑卒中和心肌梗死)优于单纯ASA组,但有还有更多的大出血事件。
基于上述研究结果,对于急性心肌梗死或支架置入术后稳定型冠心病患者,应评估缺血风险的类型。如果动脉粥样硬化负担相关风险占主导地位(例如,多血管床疾病、复发性缺血事件、心力衰竭、慢性肾病、糖尿病或多种心血管危险因素),则联合使用低剂量的伐沙班和 ASA。
图 14 实验
三、ACS患者PCI术后抗凝临床实践
聂教授介绍了首都医科大学附属北京安贞医院团队对ACS患者PCI术后抗凝的相关探索(图15),以及直接PCI后抗凝可能带来的益处。
p>
图15研究情况流程图
聂教授团队与法国国立卫生与医学研究所团队合作,利用与美国心脏协会合作的CCC-ACS项目2014-2019年的数据,根据是否接受术后抗凝的患者进行分组。以医院为随机效应,采用逆概率治疗加权和Cox比例风险模型分析住院临床结果的差异。
聂教授说,在研究中,75.4%的直接PCI患者接受了术后抗凝治疗(26 .34 826),与术后未抗凝的患者相比) ,平均年龄更小,入院时病情更稳定,出血风险评分更低。
在对基线差异进行逆概率治疗加权后,术后抗凝与住院死亡率显着降低相关(0.9% vs.1.8%;HR0. 62 ;P
因此,聂教授认为,该分析结果为直接PCI术后抗凝的应用提供了数据支持,需要大规模随机对照临床试验来验证这一假设。
最后,聂教授简单提到了这项研究(图16)。该研究已经进行了5年,目前处于跟进阶段,预计将填补国际空白直接 PCI 后患者长期使用肠外抗凝剂的领域)。空白。
图 16 研究
四、总结
总而言之,在获得更多研究成果之前,聂教授对PCI术后的抗凝策略提出了三大建议。
(一)ACS患者PCI术后急性期延长肠外抗凝治疗
1.ACS 患者可能会受益于 PCI 后短期(7 天内)长期使用肠外抗凝剂。
2.考虑到目前证据有限,不适合所有患者常规延长使用。仅推荐用于术后缺血时间复发风险高的患者。
3.如果患者有抗凝指征,包括主动脉内球囊反搏、心脏辅助装置、心房颤动、左心室血栓、机械瓣膜、肺栓塞等,需要进行全剂量抗凝治疗研究结果有望提供强有力的证据。
(二)ACS患者PCI术后稳定期停用肠外抗凝,加用抗血小板药物
对于ACS出院后1年内病情稳定的患者,如果出血风险低且缺血风险高(急性心肌梗死后,前壁心肌梗死后左心室附壁血栓风险高的患者,左室动脉瘤、冠心病+外周动脉疾病、多血管疾病等),停用肠外抗凝治疗后,可在ASA和氯吡格雷基础上加用小剂量(或血管剂量)利伐沙班。
(三)慢性期PCI术后ACS患者应重新评估缺血风险及其类型,然后再做出决定
对于 ACS 后 1 年以上的慢性期患者,建议在双联抗血小板治疗 1 年后评估缺血风险及其类型。
1.如果主要关注支架内血栓形成的风险,可以延长双联抗血小板药物治疗或使用单克隆抗血小板药物治疗。
2.如果系统性动脉粥样硬化和血栓形成的风险是主要问题,则可以考虑改用 DAPI 策略(即 ASA + 低剂量利伐沙班)。
写作排版丨傅玉杰
校对丨杨以宁
编辑审阅丨星辰
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话