欢迎光临吉康旅!
1
前言
基于抗体的药物是生物技术制药的一个重要方面,因为癌症和其他疾病的复杂性要求基于抗体的药物通过多种机制发挥作用。即使针对单一靶点,也可以根据 Ab-Ag 结合特性、诱导效应功能的能力和其他因素开发具有不同生物活性的抗体药物。因此,更好地了解基于抗体的作用机制 (MOA) 将有助于开发可提高效力和靶向精度的药物。
现有抗体药物的常见 MOA 包括 (i) 破坏配体-受体相互作用; (ii) 通过抗体依赖性细胞毒性 (ADCC)、补体依赖性细胞毒性 (CDC) 和抗体依赖性细胞毒性吞噬作用 (ADCP) 清除靶细胞; (iii) 双特异性抗体 T 细胞结合剂; (iv) 通过增强内化和降解来下调受体; (v) 靶向给药。在这里,我们通过一些典型的基于抗体的药物范例来共同回顾这些作用机制。
2
阻断配体-受体相互作用
配体-受体相互作用是许多细胞事件信号传导的第一步,包括细胞增殖、粘附和迁移,其中一些与癌症进展有关。与配体-受体界面两侧结合的抗体可破坏结合并干扰信号转导,从而阻止疾病进展。
封闭配体
在批准的治疗性单克隆抗体中,配体靶标包括生长因子 (VEGF)、细胞因子 (TNF-a、IL-1b、IL-12/23、IL-6、IL-17a、BAFF )、可溶性免疫成分 (C5、IgE) 以及病毒和细菌靶标 (RSV 和炭疽杆菌 PA)。配体结合单克隆抗体的主要机制是阻断配体与其同源受体之间的相互作用,从而抑制配体刺激的细胞信号传导。尽管这些类型的 mAb 的 MOA 相似,但由于许多固有特性,包括 mAb 结合表位、亲和力和血清半衰期,后续效果会有所不同。
例如,抗TNF-α抗体药物在临床上用于治疗各种炎症和自身免疫性疾病。 α反应速度慢,有助于形成稳定的Ab-TNF复合物,直接结合在TNFR和TNF的界面,比TNFR大。四种 TNF mAb 的表位相似但不完全相同,这些差异可能导致下游信号变化。
贝伐单抗 ( ) 是第一个在 2004 年开发并批准用于治疗结直肠癌的抗血管生成抗体药物。VEGF 的过表达刺激新生血管形成,并通过 VEGF 和内皮细胞上的信号激活促进肿瘤生长和转移。贝伐单抗的信号传导阻滞抑制血管生成信号并减少肿瘤细胞的血液供应,导致肿瘤缩小。与-VEGF界面表位结合的新型VEGF单克隆抗体与小鼠和人VEGF发生交叉反应,在阻断VEGF和VEGF相互作用方面可能比贝伐单抗更有效。
在 TNF 和 VEGF 单克隆抗体的情况下,不同的抗体结合特性导致不同的生物活性,这表明更好地了解它们的分子生物学将有助于设计具有所需功能的治疗剂,从而导致单克隆抗体的信号阻断。
阻断受体
大多数基于抗体的肿瘤药物靶向细胞表面受体。首批获批用于癌症治疗的两种单克隆抗体是抗 CD20 利妥昔单抗和抗 HER2 曲妥珠单抗。
靶向细胞表面受体的抗体的作用包括三个方面:(i)通过阻断受体与配体的结合来抑制受体信号; (ii) 下调细胞表面受体; (iii) 参与免疫效应器功能,包括 ADCC、CDC 和 ADCP。
虽然一些治疗性 mAb 依赖于破坏受体-配体相互作用才能发挥作用,例如抗 EGFR 抗体、西妥昔单抗和帕尼单抗,但它们也刺激效应器功能,这被认为对抗-肿瘤疗效。然而,在某些情况下,不需要效应器功能,例如,针对 PD-1 的检查点 mAb 和两者都是人 IgG4 亚型,与 IgG1 相比,它们缺乏补体激活和相对较低的 FcR 结合。抗PD1单克隆抗体主要干扰PD-1和PD-L1之间的信号传导,从而切断对细胞毒T细胞活性的抑制,增强细胞的抗肿瘤作用。
3
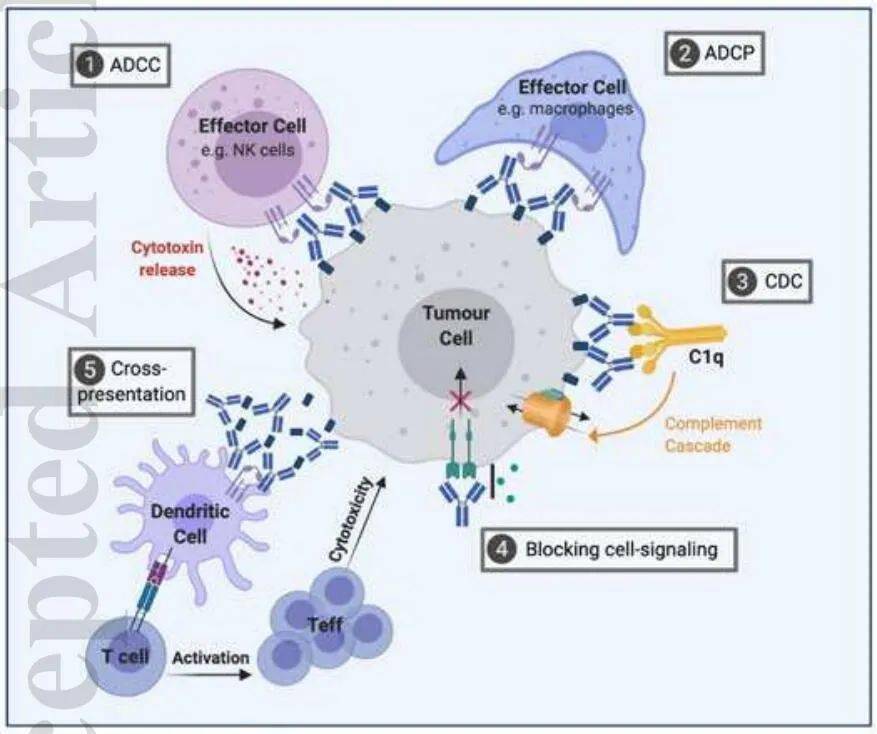
ADCC 和 CDC 的细胞清除率
单克隆抗体的大部分治疗活性来源于Fc受体结合区的效应功能,包括ADCC、ADCP和CDC。对于可溶性配体,单克隆抗体结合形成免疫复合物,可被效应细胞消除;对于细胞表面受体,单克隆抗体结合的细胞可被效应细胞攻击,导致细胞破坏和死亡。
FDA 批准了第一个 CD20 嵌合抗体利妥昔单抗,用于治疗非霍奇金淋巴瘤。自利妥昔单抗获批以来,又有两种 CD20 抗体获批用于治疗慢性淋巴细胞白血病(CLL)。虽然所有抗 CD20 抗体疗法都针对 CD20 并杀死 B 细胞,但 MOA 并不相同。利妥昔单抗的疗效主要来源于抗体所参与的效应功能,包括CDC、ADCP、ADCC。联合化疗,通过不同机制发挥作用,效果优于利妥昔单抗。
与利妥昔单抗相比,可识别更小的 CD20 细胞外环,从而触发异常强烈的 CDC 效应。是第一个获得批准的 Fc 糖工程抗 CD20 抗体,具有增强的直接和免疫效应细胞介导的细胞毒性。尽管表位与利妥昔单抗重叠,但它不会像其他 I 型 mAb 那样诱导 CD20 重新分布到脂筏中,从而引发强烈的 CDC 效应。相反,它的 MOA 通过修饰的 IgG 铰链区触发最佳的 ADCC 反应和强大的程序性细胞死亡 (PCD) 反应。
4
双特异性抗体T细胞结合剂
细胞毒性 T 细胞在许多抗肿瘤作用中起着至关重要的作用,但是,抗肿瘤 T 细胞反应受到癌细胞免疫逃避机制的限制。靶向 T 细胞受体的单克隆抗体可以模拟抗原识别的作用,诱导特异性 T 细胞增殖,并释放 IL-2 和 INF-γ 等细胞毒因子。这种与 T 细胞结合的单克隆抗体只能裂解表达 Fcγ 受体的细胞,而这些细胞不存在于肿瘤细胞中。为了将 T 细胞引导至肿瘤细胞,设计了双特异性 T 细胞接合器 ()。
BiTE 携带两种单链抗体,一种与靶肿瘤细胞上过表达的细胞表面抗原结合,另一种与 T 细胞受体中的 CD3 结合。这种双特异性分子在肿瘤细胞和 T 细胞之间建立了一座桥梁,从而激活 T 细胞并破坏桥梁另一端的肿瘤细胞。第一个靶向CD19和CD3的BiTE,即2014年12月在美国获批用于治疗急性淋巴细胞白血病(ALL)。 2009年,另一种双特异性全长IgG抗体在欧洲获批,分别有两个Fab臂靶向和CD19,用于治疗腹水型癌症。
5
通过增强的内化和降解来下调受体
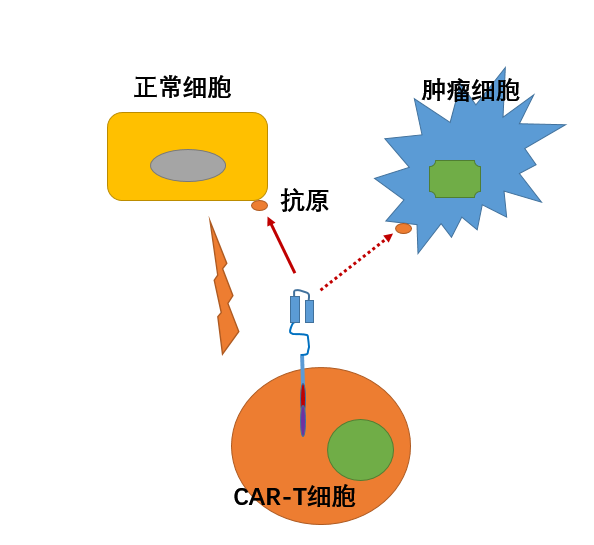
虽然人IgG1可以招募免疫细胞破坏肿瘤细胞,但以西妥昔单抗(IgG1)或帕尼单抗(IgG2))靶向EGFR,单药治疗的反应率仅为11%和8%,对于抗 EGFR 和 HER2,观察到抗体结合的非重叠表位协同下调受体酪氨酸激酶,从而更有效地阻断 EGFR 信号传导。这种方法可能代表抗体治疗的新策略。
已针对不同疾病开发了两种抗体组合。最有希望的 EGFR 双单抗组合正处于转移性结直肠癌的 3 期临床试验中。为了实现强大的协同效应,增强受体相互作用和下调,这两种单克隆抗体不仅设计用于结合不同的表位,而且还配置了最佳表位。
6
靶向给药
通过抗体增强靶向药物递送的方法包括抗体药物偶联物 (ADC) 和抗体免疫脂质体药物 (IML)。 ADC药物的MOA包括四个步骤:抗体与靶抗原结合、抗原抗体复合物内化、细胞内药物释放和有效载荷发挥,包括DNA和微管损伤,以及DNA合成中断。靶向给药的效率取决于抗原-抗体复合物的内化和ADCs的胞内分解,这可能受抗原-内吞作用和抗原-抗体结合特性的影响。
与每个抗体只能携带几个药物分子的 ADC 不同,每个免疫脂质体都封装了多个药物分子,从而允许使用效力较低的化学治疗药物。此外,与其他 ADC 相比,免疫脂质体可能具有额外的优势,因为它可以使用相同的靶向颗粒来封装用于治疗的毒性药物和用于肿瘤可视化的放射性同位素。
近 20 年来,抗体药物为许多癌症提供了临床益处。相信随着对MOA的深入了解,我们可以更快、更精准地为各种癌症患者研发出更有效的抗体药物。
参考资料:
1. 的 A 到 , 和 .
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话