欢迎光临吉康旅!
中国首个获批的第三代肺癌靶向药物
用于治疗局部晚期或转移性突变阳性非小细胞肺癌的靶向药物
2017年3月24日——阿斯利康今日宣布,国家食品药品监督管理总局(CFDA)正式批准第三代肺癌靶向药物泰瑞沙? (甲磺酸奥西替尼片)用于既往使用表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗期间或治疗后疾病进展,并通过检测证实存在突变阳性部分的成年晚期患者的治疗或转移性非小细胞肺癌()。
在我国,每年新发肺癌患者超过73万,是一种发病率和死亡率都很高的恶性肿瘤。中国约30%-40%的非小细胞肺癌患者存在EGFR突变,接受EGFR-TKI药物(如吉非替尼、厄洛替尼、埃克替尼)治疗的EGFR突变患者中,约三分之二的患者会因为突变产生耐药性,导致疾病再次进展,患者迫切需要新的治疗方案。
奥希替尼是阿斯利康开发的第三代口服不可逆选择性EGFR突变抑制剂。它是世界上第一个上市的,也是第一个被批准用于治疗小细胞肺癌的突变阳性局部晚期或转移性非肿瘤药物。2015年11月,奥希替尼获FDA批准在美国首次上市。从临床试验到上市,只用了两年半的时间。这是阿斯利康历史上最快的新药项目。去年9月,国家食品药品监督管理局根据晚期肺癌患者临床迫切需求以及奥希替尼与现有疗法相比具有明显的治疗优势,将奥希替尼列入优先审评名单,加快审批。
关键临床研究数据

特蕾莎?(甲磺酸奥希替尼片)是阿斯利康开发的第三代口服不可逆选择性EGFR突变抑制剂。它是世界上第一个上市的,也是中国第一个被批准突变阳性的。局部晚期或转移性非小细胞肺癌的肿瘤药物。
已进行的几项关键临床研究表明,特蕾莎? 对于对突变有抵抗力的非小细胞肺癌患者,它可以显着减缓或阻止疾病的进展,或缩小现有的肿瘤。
临床研究
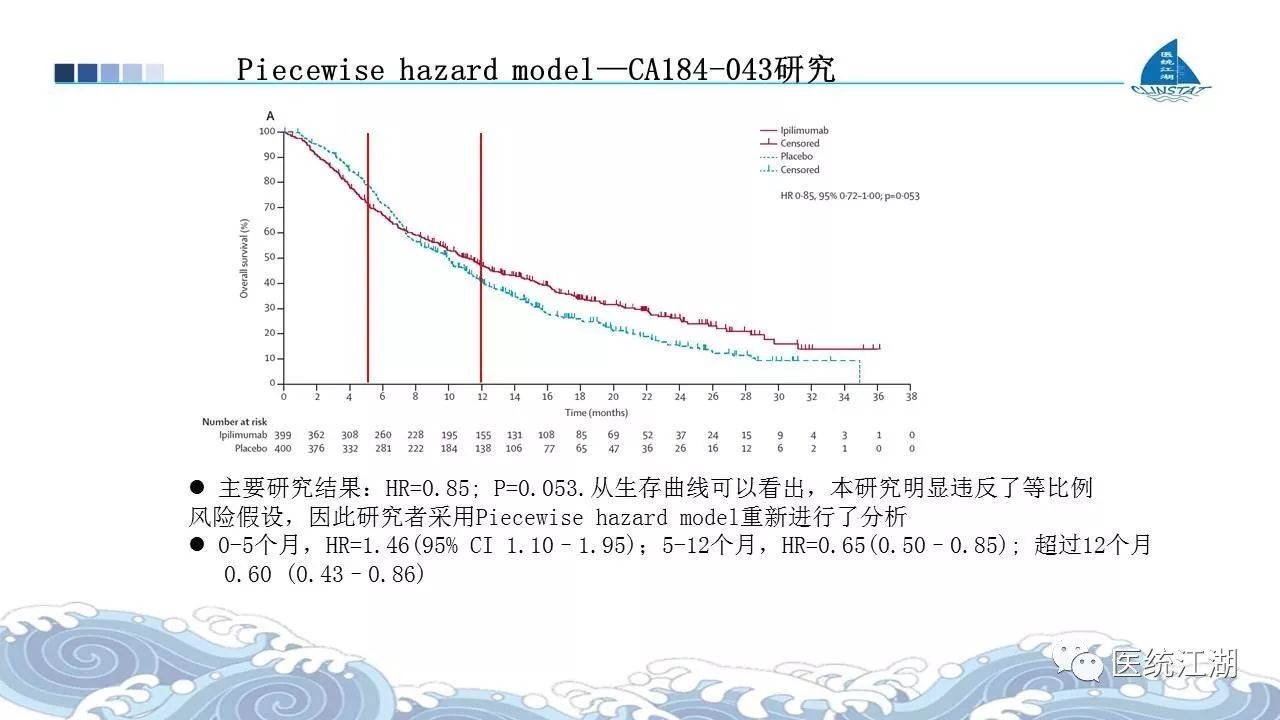
准确筛选一线EGFR-TKI治疗耐药和二线突变阳性患者的首个III期国际多中心临床研究,与化疗头对头,共纳入419例患者,其中中国患者48例。
该研究进一步验证了特蕾莎? 功效。作为非小细胞肺癌的二线临床研究,首次显示PFS超过10个月(研究评价1个月,BRIC评价11个月)。与培美联合铂类化疗相比,疾病进展风险降低70%(HR:0.30),而既往化疗达到的PFS仅为4-5个月。
临床研究
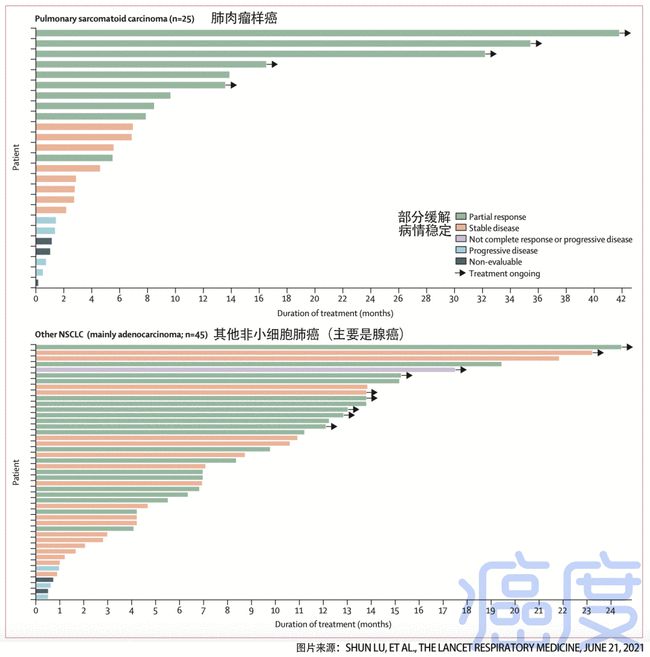
一项开放的单臂 II 期研究招募了 171 名患者,其中 148 名是中国患者,旨在评估 ? 它用于既往有 EGFR-TKI 进展或化疗进展的患者的疗效和安全性。
BICR 确认的 ORR 和 DCR 分别为 60%(95% CI,52-68) 和 88%(82-92))。中位 DoR 和 PFS 不成熟。
该数据与之前全球 II 期研究的结果相似,证实 ? 在东亚人群中的功效。特蕾莎?AE 耐受性良好,≥3 度的 AE 发生率非常低。AEs及其发生率与以往全球研究的结果相似,未发现新的AEs。
临床研究
旨在评估 的开放式两阶段 I 期研究?既往接受 EGFR-TKI 治疗的中国晚期非小细胞肺癌患者的安全性、耐受性、药代动力学和初步抗肿瘤活性。共有31名中国患者入组。
初步结果显示,特蕾莎? 中国人的药代动力学与世界一致,推荐每天一次80mg。显示出非常好的临床疗效和安全耐受性。
阿斯利康全球新药研发高级副总裁、中国新药研发部总裁陈志坚表示:
“奥希替尼的获批给EGFR突变高发的中国肺癌患者带来了新的希望,打破了中国肺癌患者EGFR-TKI治疗后耐药的瓶颈,是肺癌的靶向治疗。为了让创新药早日惠及中国患者,阿斯利康在研发初期就积极与中国肿瘤学专家和药审机构探讨奥希替尼在中国的发展战略,我们相信奥希替尼公司的获批能够带来为更多肺癌患者提供创新治疗方案并延长他们的生命。”
“感谢中国肺癌专家对奥希替尼临床研究做出的杰出贡献,感谢国家药监局及相关部门密切关注患者需求,让创新药物惠及更多中国患者的努力尽快。杰出的努力。”
阿斯利康执行副总裁、亚太及中国区总裁王磊表示:“过去十年,易瑞沙?(吉非替尼)作为中国首个肺癌靶向药物,开创了肺癌靶向治疗的先河,延长了大量肺癌患者的生命;今天,®(奥希替尼)获批,将进一步延伸和完善肺癌患者的靶向治疗方案,让更多肺癌患者继续获得高质量的生存;未来,阿斯利康将继续加大新药研发投入,加快创新药进入中国的步伐,并与政府共同推动创新药在中国的可及性和可负担性,让更多的中国患者受益尽早。”
目前,奥希替尼已在美国、欧洲、日本、韩国、香港、中国等47个国家和地区上市。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话