欢迎光临吉康旅!
“每个月的工资还不够一盒药钱,感觉像在做梦一样,真的是没有未来,也看不到未来。最近好像在破罐子破摔,越来越累了...”让刘雨(化名)花尽工资的药叫波生坦,是治疗肺动脉高血压的关键药品。一瓶波生坦售价高达3999元,刘雨可以吃一个月。
波生坦可以在不增加心率的情况下增加心脏输出量,改善特发性肺动脉高压患者的运动能力和血流动力。可惜的是,这款于2001年在美国上市,2006年进入中国市场的药品,目前国内只有原研药,尚无仿制药上市。

相比之下,有药品代购人员告诉南都记者,印度产波生坦仿制药,售价约为2300元,约为原研药6折。
近日,国家卫健委官网公布《第一批鼓励仿制药品目录建议清单》(下简称《清单》),共34种药品,刘雨依赖的波生坦就在其中。
仿制药是指在药品专利保护期结束后,由不拥有相关专利的药企生产的药品。通常,仿制药与原研药具有相似的成分、剂型、适应症、疗效,在临床上是可以替代高价的原研药的。
国家卫健委表示,《清单》内的药品涵盖专利到期和专利即将到期尚没有提出注册申请、临床供应短缺(竞争不充分)以及企业主动申报的药品。
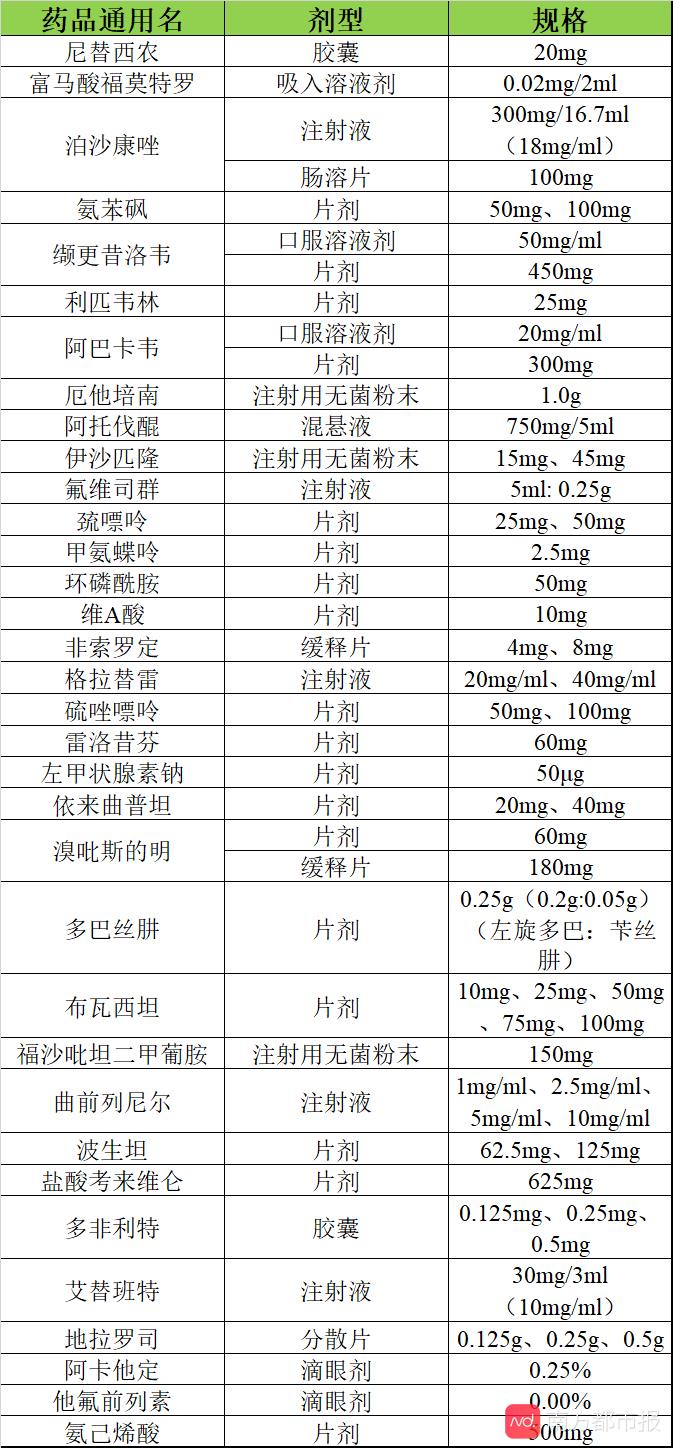
南都记者梳理发现,《清单》中药品若按剂型统计为38种,有4种药品分为两个不同的剂型。比如,治疗重症肌无力的药品溴吡斯的明就分为片剂和缓释片两种剂型。
在这38种药品中,有约4成药品(16种)国内尚未上市。
其余国内已上市的22种药品中,有7种只有国产药品,基本上都是新闻媒体报道过的短缺药。
此外,有10种只有进口药品,尚无国产仿制药上市。还有5种是既有进口药品,又有国产仿制药。
在申请仿制药方面,除去已有国产的12种药品外,其余26种药品中,有10种药品则已有仿制药在申请注册上市。还有约16种药品尚无国内药企申请仿制药注册,约占6成。
FDA橙皮书显示,这16种药品中有多款已过专利期,例如:多非利特、溴吡斯的明(缓释片)、阿托伐醌等;还有多款药品专利即将到期,例如,布瓦西坦(2021)、伊沙匹隆(2025)、阿卡他定(2027)等。
一些企业已对《清单》中的多款药品提出仿制药申请。
例如,重庆圣华曦药业股份有限公司已对缬更昔洛韦、雷洛昔芬、波生坦等提出申请;江苏奥赛康药业股份有限公司已对泊沙康唑、地拉罗司等提出申请;浙江诚意药业有限公司已对巯嘌呤、硫唑嘌呤等提出申请。
同时,《清单》中的多款药品也已有多家药企提出仿制申请。
刘雨使用的波生坦就已有重庆华邦制药有限公司、浙江华义医药有限公司、江苏亚邦强生药业有限公司、北京万生药业有限责任公司等公司、重庆圣华曦药业股份有限公司提出仿制申请;地拉罗司已有江苏豪森药业股份有限公司、江苏奥赛康药业股份有限公司、北京康辰药业股份有限公司等提出仿制申请。
值得注意的是,《清单》中有约11种药品为罕见病用药,有约6种药品为艾滋病相关用药,有约6种药品为癌症相关用药。
“我们要旗帜鲜明提出来,仿制的目的就是为了替代。仿制药替代既是国际规则和惯例,也是国办发20号文的要求”。在去年6月举办的一场关于仿制药的论坛上,国家卫生健康委员会体制改革司一名官员说到。
《清单》的出台源于去年发布的两个文件。
去年4月,国务院办公厅发布《关于改革完善仿制药供应保障及使用政策的意见》(下简称“20号文”),将鼓励仿制药的范围明确为,“临床必需、疗效确切、供应短缺”的药品。
随后,2018年12月,国家卫健委、国家发改委等12部门联合发布《关于加快落实仿制药供应保障及使用政策工作方案》(下简称《方案》)明确,要在2019年6月底前,发布第一批鼓励仿制的药品目录,引导企业研发、注册和生产仿制药。
为何要用仿制药替代原研药?与原研药不同,仿制药的研发成本、研发周期、研发风险等都相对较低,而价格相对低廉。
美国食药监局发表的一份研究显示,一种原研药到期后,第一款仿制药价格约为原研药的94%,第二款仿制药出现后,价格就会降到一半左右。当仿制药企业接近20家时,售价仅剩原价的6%。
美国仿制药协会在2017年发表的一份报告显示,仿制药在过去十年中,为美国医疗体系节省1.67万亿美元,仅2016年就节省了253亿美元。也有分析认为,在中国,如果原研药被国内仿制药取代,理论上可以节省280亿~420亿元。
对患者来说,仿制药意味着更低廉的用药价格。
南都记者统计发现,《名单》中包括利匹韦林、阿巴卡韦等抗艾滋药;伊沙匹隆、氟维司群等抗癌药;曲前列尼尔、波生坦、艾替班特、地拉罗司、尼替西农等罕见病药物在内,目前均未有国产仿制药上市。
其中,利匹韦林、阿巴卡韦、伊沙匹隆、尼替西农尚无药企在国内提出仿制申请。
除了价格高昂的原研药外,南都记者注意到,《清单》中也有多款供应短缺的低价药。
溴吡斯的明就是其中的一种。较之动辄上千上万的抗癌药等来说,一瓶溴吡斯的明售价仅在50-90元左右。不少患者每月用药量在1-2瓶,经济压力相对较小。
虽然价格低廉,但溴吡斯的明的重要性却不低于任何一种抗癌药。
《中国重症肌无力诊断和治疗指南》显示,溴吡斯的明是治疗重症肌无力的一线药物,可作为单药长期治疗轻型重症肌无力患者。另有统计数据显示,约86%的重症肌无力患者都使用或使用过溴吡斯的明,是重症肌无力患者中使用最多的药物之一。该药也因此被患者亲切的称为“小明”。
2014年就有企业获批仿制生产溴吡斯的明,目前国内已有三家药企拿到仿制批文。但几年来,因用量小、利润低等原因,实际生产“小明”的药企仅有一家。溴吡斯的明也在过去几年中多次短缺断货,药价甚至被炒到过上千元。
与“小明”相似,《清单》中的多款廉价药品也面临断货或供应不足的窘境。
上海、山东、湖南等省份在今年发布的药品短缺信息中,《清单》涵盖的溴吡斯的明、甲氨蝶呤、巯嘌呤、维A酸等药品均在列。《湖南省2018年医疗机构短缺药品清单》中,有35种药品被标注为“断货”。溴吡斯的明和甲氨蝶呤则标注为“暂无替代”药品。
四川省人民医院药学部主管药师李洪林曾统计该院特殊门诊2017年抗高血压类药物使用情况。结果显示,原研药销在售金额及销售量占比上,均占绝对优势。仿制药销售额仅占5.14%,远低于美国药品市场中,仿制药27%的销售额占比。
已有相对廉价的仿制药的情况下,为何临床还会大量应用原研药?
李洪林指出,该医院所用抗高血压仿制药中,仅一款通过一致性评价,“导致医师和患者对仿制药缺乏信心”。
一致性评价是衡量仿制药重要标准,也有人将一致性评价形容为仿制药的“及格线”。若一款仿制药通过一致性评价,则证明其与原研药具有相同的质量和疗效。
美国、日本等医药产业发到国家,在上个世纪就已开展一致性评价工作。而中国虽在2012年提出,但一直到2015年才终于启动这一进程。原国家食药监局表示,开展一致性评价,可提升中国仿制药质量和制药行业的整体发展水平,保证公众用药安全有效。
“过去我们批准上市的药品没有与原研药一致性评价的强制性要求,所以有些药品在疗效上与原研药存在一些差距”,原国家食药监局曾坦言,对已批准上市的仿制药进行一致性评价,是补历史的课。
我国一部分药品产能严重过剩,企业数量过多,甚至出现同一种药品有几百家企业有批号的情况。仿制药的一致性评价无疑是一次行业的重新洗牌。
2017年发布的《企业开展289目录内仿制药质量和疗效一致性评价基本情况表》显示,以持有文号最多的复方磺胺甲噁唑片为例,在782家生产企业中,有391家放弃评价。
《清单》中包含的氨苯砜片,4家生产企业中,有2家放弃评价;3家环磷酰胺片、6家巯嘌呤片生产企业中,也各有1家放弃评价。
不过,除了药品质量不过关外,成本也是不少药企放弃、推迟一致性评价的原因。资料显示,一个产品进行一次一致性评价的费用约在500万元左右,如果一次不能通过,反复试验后总费用可能高达千万元。
为此,国家药监局也出台一系列措施推进一致性评价。例如,通过一致性评价的品种优先纳入基本药物目录,未通过一致性评价的品种将逐步被调出目录;药品集中采购优先选用通过一致性评价的品种等。
此外,各地也针对一致性评价出台了相应的补贴政策。例如,甘肃省规定,对通过国家评价的每个品种给予300万元的补助;山东省则规定,全国前三位通过仿制药一致性评价的品种,给予一次性补助200万元。
作为与药品专利保护期(通常为20年)“打交道”的仿制药,若能在专利保护期过期后第一时间推出,不仅可让患者尽早享受到低价药,也可为企业争取更多利润。这就需要建立药品专利链接制度。
北京安杰律师事务所律师何菁曾梳理专利链接制度出现的历史。
“专利链接制度的历史和美国人在医药行业遭遇到的困境直接相关,上世纪80年代,美国人发现仿制药在市场上很难获得成功,药价迟迟难以下降,公众意见很大。”
据他介绍,彼时有研究发现,仿制药厂在面对原研药专利时,往往缺乏足够的资源和勇气进行挑战,而原研药厂也因医药监管程序丧失不少专利保护期限而士气低落。
后经美国国会讨论,出台《药品价格竞争与专利期补偿法》,形成了以专利链接制度为核心的药品审批制度。
专利链接制度涵盖专利信息公示制度、专利声明制度等。原研药上市时,药企需提供药品专利信息,美国食药监局(FDA)则会将相关信息录入橘皮书(Orange Book)供查询。仿制药在提出申请时,需对橘皮书中专利做出声明。
声明内容可包括:无相关专利登记;有专利登记但专利无效,生产、上市仿制药不会侵犯专利权;专利已过期;将在专利到期后才开始制造、销售仿制药等。
在沈阳药科大学国际食品药品政策与法律研究中心主任杨悦看来,建立实质性专利链接制度可以在一定程度上避免仿制药专利侵权风险,也可避免审评机构牵涉到专利纠纷之中。
“专利链接制度还允许仿制药通过专利挑战的方式,在原研药专利到期前上市,对仿制药研发构成激励,有利于高昂的原研药价格快速下降,提高药品可及性。”她评价到。
此外,此前在清华大学举行的一场专利链接制度研讨会上,有国内药厂高管表示,如果仿制药企业在专利挑战成功后,仿制药能直接进入医保药品目录,“那才是真正解决了仿制药厂最关切的问题。”
何菁也指出,由于医院采购周期、医保目录更新周期等的限制,让仿制药厂“特别头疼”。如何进入市场、如何能进入医保目录、药品目录、扩展覆盖面,往往是药厂最关心的问题。
中国药科大学国际医药商学院原院长邵蓉也曾在接受媒体采访时指出,受上述周期限制,患者也只能“望药兴叹”。
对此,国家卫健委和发改委等部门出台的《方案》表示,要逐步探索研究药品专利链接制度,降低仿制药专利侵权风险。制定专利挑战制度实施细则,明确专利挑战申报、受理、结果公示相关程序。
“20号文”则提出,建立完善基本医疗保险药品目录动态调整机制,及时将符合条件的药品纳入目录。要及时更新医保信息系统,确保批准上市的仿制药同等纳入医保支付范围。通过医保支付激励约束机制,鼓励医疗机构使用仿制药。
此外,《2019年国家医保药品目录调整工作方案》在今年4月发布后,国家医保局在解读中表示,“考虑到部分专利独家药品的仿制药可能会在目录调整期间上市,在此次调整中规定对独家药品的认定时间以遴选投票日的前一天为准。”
注:药品数据综合自丁香园Insight数据库、药智数据、ChemicalBook
采写:实习生 宋承翰 南都记者 吴斌
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话