欢迎光临吉康旅!
一、前言
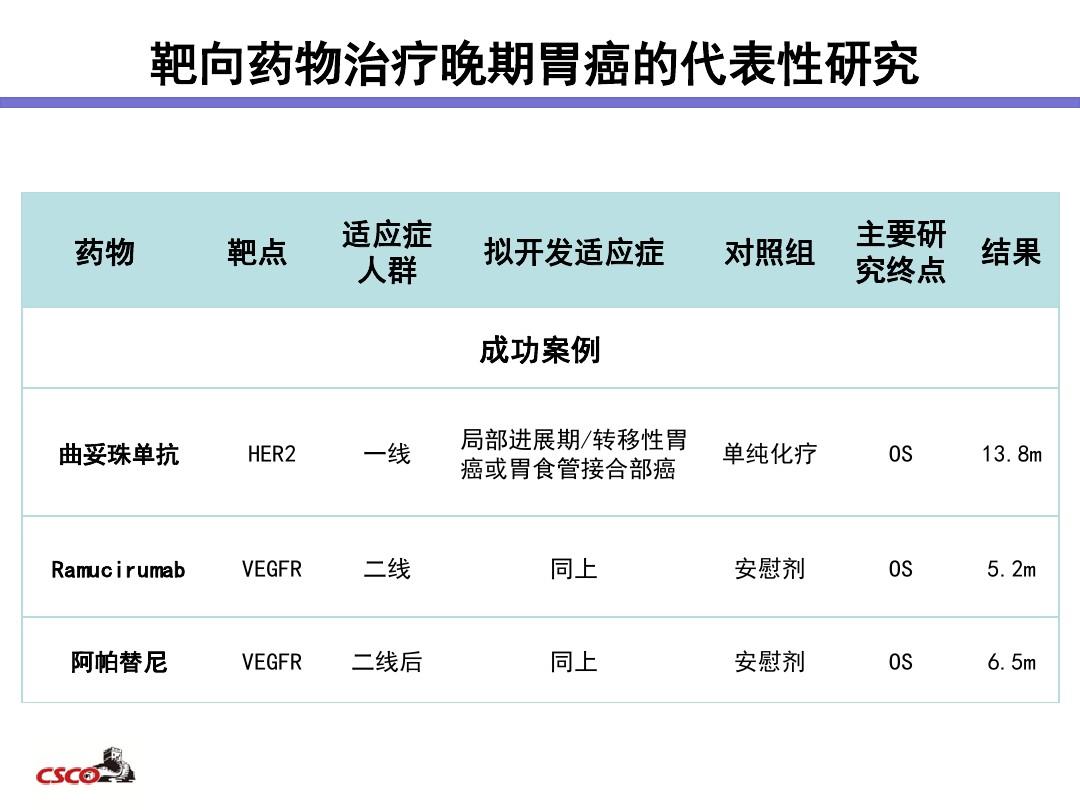
贝伐单抗注射液()由瑞士罗氏公司研制,商品名为阿瓦斯汀()。哺乳动物细胞表达的抗人血管内皮生长因子(VEGF)单克隆抗体制剂用于阻断VEGF与其内皮细胞上的受体结合,使VEGF失去生物学活性,从而减少肿瘤血管生成,抑制肿瘤生长。 2004年2月首次获得美国FDA批准,与5-氟尿嘧啶联合化疗用于转移性结直肠癌患者的治疗。它是世界上第一个获批的靶向 VEGF 的药物。此后,它被批准用于非小细胞肺癌、肾癌、神经胶质瘤、卵巢癌、宫颈癌等适应症。在中国,贝伐单抗注射液于2010年2月获准进口注册,目前批准的适应症仅包括结直肠癌和非小细胞肺癌[1]。
贝伐单抗注射液原产品专利即将到期(2019年欧洲专利,2017年美国专利)[2],国内外多家药企纷纷加入其生物类似药的研发进程。为了更好地推动生物类似药的发展,我们根据国家食品药品监督管理总局发布的《生物类似药开发与评价技术指南(试行)》,结合该品种的特点,制定了贝伐单抗生物类似药。贝伐单抗的临床研究策略和评价要点有望为贝伐单抗生物类似药的开发者提供参考。
二、贝伐单抗生物类似药临床研究策略
生物类似药研发的总体思路是通过比对试验来证明其与参比药的相似性,以支持其安全性、有效性和质量控制。药物、非临床和临床比较试验是分阶段进行的。根据前期对比测试的结果,设计了后续对比测试的内容。
根据以往药理学和药理学毒理学比较的结果,贝伐单抗生物类似药的临床开发可能有以下两种情况:
1、药理药理毒理试验证明试验药与对照药相似,按照生物类似药的路径进行药代动力学比较试验和临床安全性与疗效比较试验。鉴于国内外贝伐单抗批准适应症的差异,临床安全性和疗效比较试验中可能出现以下四种选择:
①选择国内批准的适应症,对研究人群进行与原研药,多为非鳞状细胞非小细胞肺癌( )的“头对头”等效性研究,主要终点为一个敏感和客观的疗效指数反应率(ORR)被用作替代终点。
2 选择国内批准的适应症作为研究人群,但不与原研药进行“头对头”等效性研究,而是使用选定适应症的现行标准治疗方法之一作为对照。主要终点指标是临床终点而非替代终点,如无进展生存期(PFS)、总生存期(OS)等。
③在国外已获批但国内尚未获批的适应症进行临床研究,如肾癌、卵巢癌等,选定适应症的现行标准治疗方法之一也可作为控制。主要终点是临床终点,而不是 PFS、OS 等替代终点。
④针对黄斑变性(AMD)等国内外尚未获批的适应症人群进行临床研究。
对于以上4种情况,①是目前研发公司最常选择的路线。按照该途径完成单一适应症的研究,可以获得外推其他适应症的批准。根据路径②③④的研发策略,由于与原研产品没有“头对头”比较,无法完全证明相似性。因此,在现有①研发路径的条件下,此类产品应按照新药路径进行开发。
2、药理及药理毒理试验未能证明供试药与参比药相似,按新药研发路径研制。
按照新药途径开发的产品应进行全面、系统的临床试验,以体现其与现有疗法相比的临床优势。明显的临床优势是指解决未满足的临床需求(例如对贝伐单抗治疗失败的患者有效),或具有更好的疗效,或未显着提高疗效但显着提高安全性。
三、贝伐单抗临床研究设计要点
临床比较研究通常从药代动力学和/或药效学比较研究开始,后续的临床有效性比较研究根据其相似性评估的结果来考虑。研究设计应以证明候选药物与原研药物的相似性为目标,进行科学合理的研究设计。在合理科学依据的前提下,尽可能简化研究,降低成本。由于缺乏合适的药效学终点,目前国内外贝伐单抗生物类似药的临床开发多为药代动力学比较研究和临床安全性与疗效比较研究。
1、药代动力学比较研究(PK比较研究)
实验设计:参考一般生物等效性研究的设计,结合贝伐单抗生物类似药的长半衰期(18-20天)和免疫原性的特点,该产品不适合交叉设计评价其生物等效性,建议采用随机、双盲、两组、平行对照试验设计。罗氏生产的贝伐单抗有来自欧洲和美国的产品。在中国上市的贝伐单抗是欧洲原产的产品,因此应选择欧洲原产的产品作为对照药。
单剂量PK比较研究便于比较组间差异,因此建议进行单剂量PK比较研究。
多剂量PK比较研究不如单剂量PK比较研究敏感,但可以间接反映贝伐单抗的剂量和时间依赖性免疫原性,以及酶介导、靶标介导、FcRn介导和其他相关药物清除。建议在完成单剂量PK比较研究确定相似性后,在临床疗效比较研究中,同时考察多剂量PK特征。免疫原性评价应贯穿整个临床比较研究。
研究人群:健康志愿者是理想的均质试验人群,更能反映候选药物与原研药物的PK差异。由于该研究的主要目的是检查相似性,因此不考虑性别差异,通常选择健康的男性志愿者,无需同时考虑男性和女性受试者。由于受自身基础疾病的影响,肿瘤患者不利于PK差异的比较评价,因此不建议选择肿瘤患者进行研究。
剂量和给药途径:该研究的目的是证明 PK 相似性,因此不需要临床推荐的剂量。原药贝伐单抗的药代动力学在1mg/kg~10mg/kg的剂量范围内呈线性关系[3],因此可选择该范围内的剂量。如果选择健康受试者,从保护受试者的角度出发,应在检测方法的定量下限允许的范围内选择较低的剂量。同时,较低的剂量更容易比较候选药物和参比药物之间的差异。因此,建议在单剂量PK比较研究中选择1 mg/kg的剂量,其他剂量如3 mg/kg或5 mg/kg也是可以接受的。给药途径为静脉给药,与原研药一致。静脉给药时应注意控制输液速度,尽量使给药结束时间一致,以利于相似性评价。
终点和临界值:PK 比较研究的主要终点的选择是等效性评估的关键。根据口服固体制剂相关指南[3],AUC0-∞和Cmax是判断生物等效性的主要参数。但在评价生物类似药的生物等效性时,究竟应该选择AUC0-t还是AUC0-∞作为终点仍存在争议。 FDA 在其生物仿制药指南中倾向于选择 AUC0-∞ 作为静脉给药的主要终点 [6]。我们认为 AUC0-t 是根据实际测量值计算得出的。考虑到生物类似药药代动力学的特点和实际研究过程中采血点设计的相关性,推荐将AUC0-t作为研究的主要终点。 AUC0-∞ 和 Cmax 用作比较分析的次要终点。根据传统建议,等效截止值设置为 80%-125%。
样本量:样本量根据设定的等价阈值(80%-125%)、置信区间(90%以上)、功效(通常在80%以上)等参数计算得出,应结合原研药以往资料考虑药代动力学参数的变化,建议研发企业根据自身情况和发展目标适当扩大样本量,防止后续研究分析中样本量不足。
2、效果比较研究
试验设计:临床疗效比较试验研究应以原研药为对照,进行随机、双盲、平行对照设计。推荐等效设计,不推荐非劣效设计。
研究人群:应根据参比药物的临床试验数据和批准的适应症选择最能反映临床疗效的人群。贝伐单抗目前在中国获批的适应症是“以5-氟尿嘧啶为基础的联合”化疗用于转移性结直肠癌患者;卡铂和紫杉醇联合用于不可切除的晚期、转移性或复发性非鳞状非小细胞肺癌患者的一线治疗”[1]。贝伐单抗联合含铂化疗在非小细胞肺癌中开展了多项大规模随机对照研究,可获得相对较多的参考疗效数据,包括卡铂和紫杉醇的国内注册临床试验[4] ]。因此,建议选择转移性或复发性非鳞状细胞非小细胞肺癌患者作为研究人群,这也是目前国外研究产品中使用的研究人群。
虽然结直肠癌适应症在中国也获批,但支持注册的临床试验采用贝伐单抗联合改良IFL(伊立替康、5-氟尿嘧啶和亚叶酸)的化疗方案,目前推荐的转移性结直肠癌治疗方案已改为//联合西妥昔单抗(推荐用于 Ras 野生型患者)或//联合贝伐单抗。不同联合方案中贝伐单抗的剂量也不同。因此,新方案在中国人群中的参考疗效数据有限。而且贝伐单抗在结直肠中的疗效比较低,不容易比较差异。因此,结直肠癌不是生物相似性评价的敏感人群。
如果考虑选择结直肠作为目标研究人群。然后,需要充分支持和确定联合化疗方案、研究终点和等效阈值的选择。建议及时与管理部门沟通,达成共识方案。

给药方案/剂量:可以通过在参考给药剂量范围内选择剂量来进行剂量选择。原产品针对不同的适应症,在不同的组合方案中推荐剂量不同。国内批准的大肠癌适应症剂量为5mg/kg,每2周一次,适应症为15mg/kg,每3周一次。如果选择作为研究人群,推荐剂量为15 mg/kg,q3w,尽可能与国内批准使用的原研药一致。
如果选择CRC,剂量为5mg/kg,每2周一次,低于中的剂量。因此,如果CRC适应症的临床比较研究证实两者相似,是否以支持推断,需要进一步讨论。
研究终点:目前,ORR 被普遍接受为主要终点。国内外在研贝伐单抗生物类似药治疗肺癌的Ⅲ期临床试验均以ORR为主要终点。
研究文献表明,单独给予含铂化疗时,四个周期的化疗和持续化疗直至进展的肿瘤缓解率相似,这表明更多周期的化疗并没有提供更多的临床益处 [5 -6]。在一项关于化疗联合贝伐单抗的日本临床研究中,中位缓解时间为 6 周 [7]。 ASCO 指南还建议一线化疗建议对 4 个周期后未出现缓解且仍处于稳定状态的患者进行转换治疗。因此,一些开发人员还提出使用第 12 周的总体缓解率 ORR 作为等效性评估的主要疗效终点。由于 12 周评估收集了最大的疗效数据,与随后的时间点相比,12 周 ORR 避免了同质人群中数据缺失率最低的情况。但鉴于目前尚无关于化疗和贝伐单抗缓解时间的证据,该评价建议同时收集第 18 周和第 24 周的 ORR 比较数据,并对所有获得的结果进行综合评估。法官。次要终点,如总生存期 (OS)、无进展生存期 (PFS) 和缓解持续时间 (DOR) 也作为支持。
边界值选择和样本量计算:目前国际学术界在计算和设定阈值时,候选药物组之间研究终点的差值(Risk,RD)或比值(Risk,RR)与参比药组仍存在争议。一般来说,RR和RD在大多数情况下是等价的,但后者更容易受到研究终点本身的可变性的影响,而前者更直接。推荐使用RR计算建立贝伐单抗疗效等效阈值的比较研究。
目前已发表的比较贝伐单抗联合化疗和单用化疗作为一线治疗的II/III随机对照研究包括5项国外研究[7-11]和一项在中国注册的临床试验[7-11]4] 根据满足筛选标准的研究的荟萃分析,根据治疗效果的置信区间下限估计截止值。 FDA在2016年发表的一份文件提出[12],如果根据国外4项贝伐单抗的随机对照研究进行荟萃分析,则在[0.7368,1.3572处获得等效边界。 ],在 80% 的功效下,估计的最小样本量为 608 个案例。在中国,应考虑贝伐单抗在中国转移性或复发性非鳞状非小细胞肺癌患者中的注册临床研究数据,并据此计算合理的临界值。在讨论贝伐单抗生物类似药临床评价的技术要求时,建议的临界值根据RR设定为(0.75, 1/0.75)。 -PK 对比研究数据显示,生物类似药与参比药一致,因此使用实际RR的90%以上的置信区间进行等效性判断是可以接受的,如果采用全球发展战略,则要求需要考虑不同的监管机构。
3、安全性和免疫原性研究
免疫原性研究是生物大分子药物独特而重要的研究项目,应贯穿整个研发过程。
与所有治疗性蛋白质一样,贝伐单抗具有潜在的免疫原性。目前关于原药免疫原性的信息是“在结肠癌辅助治疗的临床试验中,化学发光检测(ECL)被用于2233名可评估患者,14名患者(0.63%)治疗-诱导抗贝伐单抗抗体检测结果阳性。在这 14 名患者中,3 名患者通过酶联免疫吸附试验 () 检测出抗贝伐单抗中和抗体阳性。贝伐单抗抗体的临床意义尚不清楚。免疫原性检测结果与检测的敏感性和特异性高度相关,可能受以下几个因素的影响:血样处理、采样时间、伴随药物和合并症等。比较抗贝伐单抗抗体的发生率与发生率由于上述原因,抗其他药物抗体可能会产生误导。”基于上述有限的内容[1]和文献资料,结合抗药抗体(ADA)迟发性的一般经验规律提示,贝伐单抗的临床免疫原性比较研究至少应观察并获得一年左右的数据(超过 45 周)并对其进行分析。候选药物免疫原性研究可与同一临床试验中临床疗效的比较研究相结合。鉴于贝伐单抗抗原研究药物的免疫原性较低,在完成预设的疗效终点观察后,可以设计交叉药物,在更大的样本人群中收集候选药物的免疫原性。
在药代动力学、药效学和/或有效性的比较研究中也进行安全性比较研究,观察和比较不良反应的类型、严重程度和频率,特别强调不良反应的特征。建议在足够长的观察期内提供安全信息,以充分暴露潜在风险。结合贝伐单抗的现有数据和免疫原性观察的要求,建议在完成主要终点观察后收集至少一年的单药维持治疗的安全性数据,并收集随访的生存数据。 2 年。
四、总结
贝伐单抗生物类似药的临床相似性研究遵循生物类似药临床相似性评价的一般规则,但有其产品特异性,需要有针对性的临床比较研究设计,这也符合生物“case by case”的设计理念"用于技术药物临床研究。
需要注意的是,基于生物类似药的评价原则,在合理科学依据的前提下,应尽可能简化临床研究的设计,以确认候选药物与候选药物的相似性为目标。原产品。如果开发生物类似药的临床研究成本高于新药研发成本,将违背生物类似药指南设计的初衷,必然导致研发企业选择成本更低的路径用于研发,不利于监管部门的管理。因此,监管部门一方面要不断完善法规指导原则体系建设,引导行业规范研究。另一方面,应鼓励研发公司与管理部门之间的沟通,探索更好、更简单、更高效的研究设计方法。本文中的描述仅代表当前审核部门的理解。预计随着生物类似药研究的不断深入,更多的数据和证据将不断涌现,对生物类似药的认识也将更加清晰,也有可能以较少的研究被接受。越来越多可靠的相似性证据支持在更短的时间内获得产品批准。
真诚欢迎各界人士提出宝贵意见和建议。
联系人:高六村:
陈晓媛:
参考资料:
[1] CFDA。贝伐单抗注射液使用说明。 2015.
[2] A. 可以下一个- ? Nat Rev 药物。 2012 年 6 月 1 日;11(6):426-8.
[3] CFDA。以药代动力学参数为终点评价指标的化学药仿制药人体生物等效性研究技术指南。 2016.
[4] 周C,吴以礼,陈G,刘X,朱Y,卢S,冯J,何J,韩B,王J,,胡C,H,G,宋X,卢Y,潘 H,W,尹 AY。 : A , -, -, , III -Line / Plus 或 in 或 Non-Cell Lung 。临床杂志.2015 年 7 月 1 日;33(19):2197-204.
[5] MA,MJ,A,K,S,R,P,LeeJ,Lee JH,M,M,Kies MS。 IIIa 的 by-line in-IIIB/IV 非细胞肺。临床杂志。 2002年3月1日;20日(5):1335-43.
[6] Park JO, Kim SW, Ahn JS, Suh C, Lee JS, Jang JS, Cho EK, Yang SH, Choi JH, , Park SY, Shin SW, Ahn MJ, Lee JS, Yun YH, Lee JW,Park K. III 中的两个,四个中的两个,非细胞肺中的两个。 Ĵ。 2007 年 11 月 20 日;25(33):5233-9.
[7] Niho S, H, H, T, Y, Hida T, N, M, T, K, K, S, A, S, , Mori K, H, H, K, S, N,米; . II of line-with or in with non---cell lung。肺 。 2012年6月;76(3):362-7.
[8] A、格雷 R、MC、J、JH、A 等人。 – 或用于非细胞肺。英语355:2542–50.
[9]。 M、T、H、Y、Y、Hida T 等人。 ,open-, II of in with and in- with or non-cell lung (): 。临床杂志 2009; 27(15s)[.8036]。
[10]。 DH、L、WF、RS、JJ、DM 等。 II plus and with and in or non-细胞肺。临床杂志 2004; 22:2184–91.
[11]。 Reck M、von J、P、R、V、V 等。 with - and or as -line for non-cell lung : 来自 III ()。 2010 年; 21:1804 –9.
[12] He K, Chen H, T, S, S, P, R, R. in a in an .临床研究。 2016年11月1日;22(21):5167-5170.返回搜狐,查看更多
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话