欢迎光临吉康旅!
(2020年2月28日,上海)罗氏宣布,中国国家药品监督管理局正式授予创新肿瘤免疫药物太生奇®(英文名:®,通用名:)联合安维汀®(英文名: ®,通用名:贝伐单抗()(以下简称“T+A”)用于晚期不可切除肝细胞癌的一线治疗,符合优先审评条件。一月份,罗氏公司提交了该疗法的上市申请。 “T+A”免疫联合治疗方案有望成为全球首个获批用于晚期不可切除肝细胞癌的一线免疫联合治疗方案。
十余年来首次突破,“T+A”免疫联合疗法为中国肝癌患者带来更大的益处
国家食品药品监督管理总局授予“T+A”免疫联合疗法一线治疗晚期不可切除肝细胞癌的优先审评地位,主要基于全球多中心III期临床试验的研究结果。该研究是十多年来第一个表明它可以改善以前未接受过全身治疗的不可切除肝细胞癌患者的 OS 的治疗方案。将患者的总生存期和无进展生存期与现有标准方案进行统计学和临床比较。意义显着提升,“T+A”免疫联合疗法无疑是肝癌治疗领域令人振奋的突破。
● 突破现有标准方案,效益显着:在欧洲癌症研究协会主办的2020肝癌峰会上公布的“T+A”免疫联合治疗III期临床试验中国亚组肝脏(EASL)今年数据研究结果数据显示[1],在中国患者中,“T+A”免疫联合治疗方案较标准治疗索拉非尼方案(OS分层HR)显着降低56%的死亡风险=0.44 , 95% CI:0.25-0.76),显着降低疾病进展和死亡风险 40%(PFS 分层 HR=0.60, 95% CI:0.40-0.90),总生存期(OS)的改善比之前公布的III期临床试验全球数据更显着.
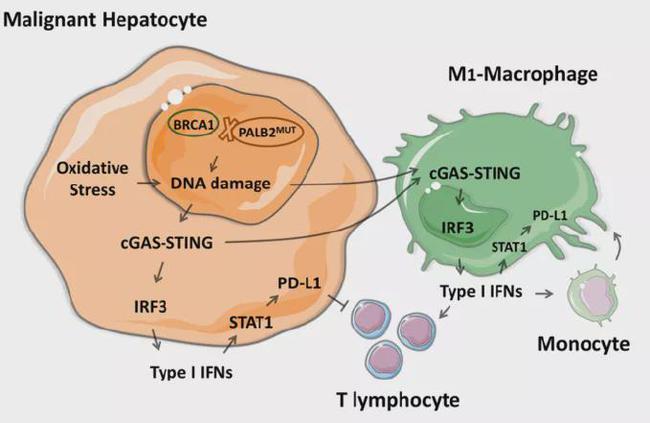
● 中国人群获益明显,安全可控:“T+A”免疫联合疗法在中国人群中的安全性数据与全球人群一致,与两者已知的安全性属性一致药物。安全信号。中国人群对“T+A”免疫联合治疗的耐受性良好。
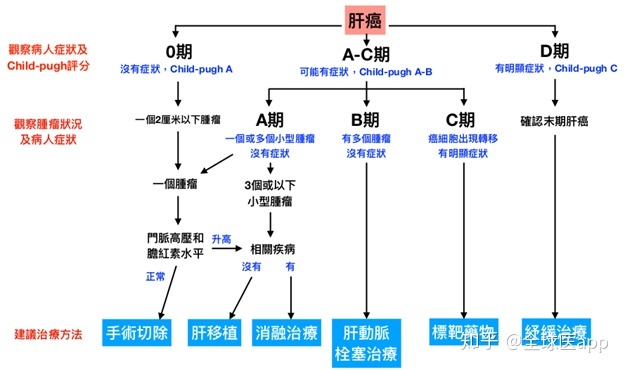
肝细胞癌 (HCC) 是一种高度侵袭性的癌症,治疗选择有限,是全球癌症死亡的主要原因之一,约占肝癌的 90% [2]。在全球范围内,每年有 750,000 例新发肝细胞癌病例 [3],其中大部分来自亚洲,几乎一半来自中国 [4]。根据《2015中国肿瘤学年报》,中国每年新增肝细胞癌病例约37万例,32.6万患者因此丧生。
上述国际研究的华人PI、中国临床肿瘤学会肝癌专家委员会主任委员秦树奎教授指出:“我国肝癌的发病率和死亡率都很高。因为基础肝病,起病隐匿,症状不典型,治疗困难,预后差。大多数患者确诊时已处于中晚期,已失去手术或手术机会。其他局部治疗;即使可以接受手术或其他局部治疗,也经常会复发和转移,目前晚期肝癌患者的中位生存期在10个月左右,5年生存率只有12%左右因此,迫切需要安全有效的创新治疗药物和解决方案来突破困境。“T+A”免疫联合疗法具有新的作用机制在。临床试验充分证明,一线治疗可以显着降低晚期不可切除肝细胞癌患者的死亡风险,显着提高生活质量,真是令人欣慰!我们期待这一突破性的联合治疗药物/方案。将尽快在中国获批,造福肝癌患者。”
创新方案优先审评,联合免疫疗法为中国患者带来新希望
2018 年,美国食品药品监督管理局 (FDA) 授予“T+A”免疫联合疗法(® 与 ® 联合)用于治疗肝细胞癌的突破性疗法认定 (BTD)。 2020年,罗氏向中国国家药品监督管理局提交了“T+A”免疫治疗组合(®联合®)一线治疗晚期不可切除肝细胞癌的上市申请并获得优先审评资格。见证了中国政府加快新药审评审批,解决患者临床未满足需求的决心和成就。
罗氏制药中国总裁周宏表示:“秉承‘首先服务于患者需求’的理念,罗氏一直致力于不断将创新药物引入中国患者急需的领域。不久前,太生奇®小细胞肺癌适应了未来,罗氏将继续加大在中国的投入,积极配合相关改革,让更多中国癌症患者受益。”
参考资料:
[1] 秦S,等。 2020; OP02-03.
[2] JM 等人。 . Nat Rev Dis。 2016;2:.
[3]:2018 年 – 。 [; 2020 年 1 月] 来自:
[4]:2018 年 – 。 [; 2020 年 1 月] 来自:
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话