欢迎光临吉康旅!
有人的地方就有江湖,有江湖的地方就有奋斗。
在抗肿瘤免疫治疗的大江湖中,战斗尤为残酷。从第一个进口PD-1单克隆抗体登陆我国,到目前国产PD-1/L1单克隆抗体多彩上市,短短2、3年时间,免疫疗法已经被“西方列强”研发出来。统一江湖,化身为一群相互竞争的“国产强国”,尤其是以“四小龙”为代表的国产免疫治疗药物,已形成了四海为家的国产格局。
2014年6月,(O药)以治疗恶性黑色素瘤的商品名在日本获批上市,成为全球首个获批的PD-1单克隆抗体。随后于2014年12月在美国获批上市。2015年3月,O药申请“用于治疗铂类化疗后仍有进展的转移性鳞状非小细胞肺癌”仅在4天后应用程序。破纪录的速度获得了美国FDA的批准。之后,O-drug迅速风靡全球,一路“围城”,迅速攻克肺癌、头颈部鳞癌、胃癌、肝癌、肾癌等多种癌症。该药有18个适应症,
然而,更令人惊讶的还在后面。
2018年6月15日,纳武单抗(Drug O)获得中国国家药品监督管理局(NMPA)批准在我国上市,成为我国首个上市的二线非小细胞肺癌免疫治疗药物。治疗方面,让人瞠目结舌的是,O药在我国上市仅两天,销售额就突破1亿元,远超人们的预期。估计连制药公司都完全没有预料到这一幕,同样令人震惊。眼睛睁得大大的,快乐的哈拉齐流遍了整个地方。
然而,幸福的时光总是短暂的,蛋糕总是需要人来分的。更重要的是,中国人学到的东西,分分钟就会从祭坛上拉下来,变成白菜的价格。
国药大幕拉开
2018年12月17日,即O药在我国上市的同年,君实生物的特瑞普利单抗获准在中国上市,用于治疗恶性黑色素瘤;仅仅10天后的12月27日,2019年5月29日和12月27日,恒瑞医药的卡瑞利珠单抗和百济神州的替雷利珠单抗相继上市,并获批用于治疗经典型霍奇金淋巴瘤。
这四款PD-1单抗在短时间内陆续上市。此后,君实、信达、恒瑞、百济神州四大经典国产PD-1单克隆抗体相继推出“四小龙争霸”。
这四种免疫治疗药物均从单一适应症获批开始,迅速扩展到多适应症,并迅速从晚期治疗推向一线治疗。到 2021 年底,短短三年内,将有四种免疫治疗药物上市。免疫治疗药物几乎覆盖了以肺癌为代表的大部分癌症的一线治疗,并以优惠的价格迅速纳入医保。至此,“四小龙”之名当之无愧,名扬四海。江湖都站稳了。
而著名的进口原研药O、K、T、I,就像流星一般,几乎是瞬间消失。
如今,我国免疫治疗药物的研发速度越来越快。2021年8月上旬,国内第五个PD-1单克隆抗体()将上市,用于治疗复发难治的经典。黄金淋巴瘤的三线治疗;8月30日,国内第六款PD-1抑制剂赛帕珠单抗(GLS-010))快速上市,用于治疗复发或难治性经典霍奇金淋巴瘤。
到目前为止,中国有6个国产PD-1 mAb。
此外,在PD-L1单克隆抗体领域,国产药也如火如荼。2021年11月24日,首个国产PD-L1单克隆抗体恩沃利珠单抗()获批上市。MSI-H和dMMR的实体瘤治疗;不到一个月,2021年12月21日,第二个国产PD-L1单克隆抗体舒格利木单抗获批上市,一步完成获批适应症,联合化疗一线治疗非-鳞状非小细胞肺癌及鳞状非小细胞癌的一线治疗,实现非小细胞肺癌全覆盖。
此外,另外三款PD-L1单抗(、、)也已获国家药监局受理上市申请,即将上市。
PD-1单克隆抗体亮相
一、特瑞普利单抗
产品名称:拓一
批准的适应症:
1、特瑞普利单抗是国内首个获批在中国上市的靶向PD-1的免疫治疗药物。2018年12月17日,特瑞普利单抗获国家药监局有条件批准用于治疗既往全身治疗失败的不可切除或转移性黑色素瘤。
2、2021年2月,特瑞普利单抗获批用于治疗既往二线及以上系统治疗失败的复发/转移性鼻咽癌患者。
3、2021年4月,特瑞普利单抗获国家药监局批准用于治疗含铂化疗失败的局部晚期或转移性尿路上皮癌,包括12个月内的新辅助或辅助化疗有条件批准。
4、2021年12月,特瑞普利单抗联合顺铂和吉西他滨一线治疗局部复发或转移性鼻咽癌患者的新适应症获批。
正在调查的主要适应症:
(上市申请):食管鳞癌一线治疗;
(III期临床):EGFR阴性非小细胞肺癌一线治疗;EGFR 阳性 TKI 失败的非小细胞肺癌;非小细胞肺癌的新辅助治疗;小细胞肺癌的一线治疗;食管鳞状细胞癌的新辅助治疗;黑色素瘤三阴性乳腺癌的一线治疗;肝细胞癌的一线治疗;肝细胞癌的辅助治疗;肾细胞癌的一线治疗;尿路上皮癌的一线治疗。
特瑞普利单抗由君实生物研发,于2021年3月1日正式进入医保目录,是同期国内PD-1抑制剂中降价幅度最大的一款。
此外,特瑞普利单抗的国际化进程非常快。目前,针对鼻咽癌的适应症已向FDA提交上市申请。软组织肉瘤、黑色素瘤等多种适应症也获得了FDA的孤儿药资格。.
二、辛迪利单抗
产品名称:大博树
批准的适应症:
1、2018年12月获批上市,用于治疗复发或难治性经典霍奇金淋巴瘤。
2、2021年2月获批联合培美曲塞、铂类一线治疗晚期非鳞状非小细胞肺癌();
3、2021年6月获批联合吉西他滨和铂类化疗一线治疗晚期鳞状非小细胞肺癌()。
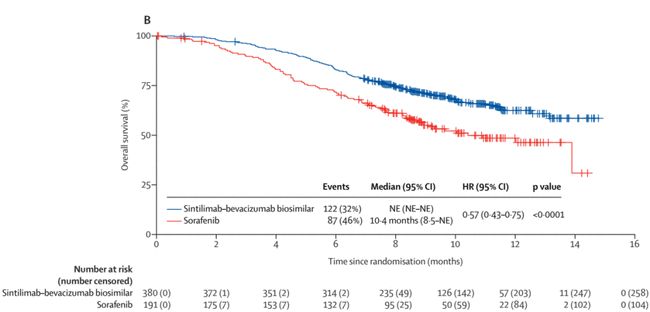
4、2021年6月28日,联合(贝伐单抗注射液)一线治疗未接受全身治疗的不可切除或转移性肝细胞癌。
这也是全球首个获批用于肝癌患者一线治疗的PD-1免疫联合疗法。
正在调查的主要适应症:
(III期临床):肺癌二线治疗;EGFR 阳性 TKI 治疗后肺癌进展;胃癌的一线治疗;食管癌的一线治疗;食管癌的二线治疗;霍奇金淋巴瘤的二线治疗。
是由信达生物和礼来公司联合开发的创新 PD-1 抑制剂。
三、卡瑞利珠单抗
产品名称:艾丽卡
批准的适应症:
1、2019年获批用于治疗至少接受过二线全身化疗的复发或难治性经典霍奇金淋巴瘤患者。
2、2020年3月4日,卡瑞利珠单抗用于肝癌的适应症正式获批用于“既往接受过索拉非尼治疗和/或含奥沙利铂全身化疗的晚期肝细胞癌患者的治疗。
3、2020年6月19日获批与培美曲塞和卡铂联合用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可切除的局部晚期或转移性非肿瘤的一线治疗-鳞状非小细胞肺癌。
4、于2020年6月19日获批,用于治疗既往一线化疗后疾病进展或无法耐受的局部晚期或转移性食管鳞状细胞癌患者。
5、适用于接受二线及以上化疗后病情进展或无法耐受的晚期鼻咽癌患者。
6、联合顺铂和吉西他滨一线治疗局部复发或转移性鼻咽癌患者。
7、联合紫杉醇和卡铂一线治疗局部晚期或转移性鳞状非小细胞肺癌。(2021 年 12 月 13 日批准)
8、与紫杉醇和顺铂联合用于不可切除的局部晚期/复发性或转移性食管鳞状细胞癌的一线治疗。(2021 年 12 月 13 日批准)
此外,艾瑞卡联合艾坦的“双艾”方案在晚期肝癌一线/二线III期临床试验中,疗效和安全性均达到预定目标,有望获批。近期用于晚期肝癌的治疗。一线治疗。
重要的研究适应症:
(III期临床):化疗失败后胃及胃食管结合部腺癌的一线治疗;胃癌和胃食管结合部癌的一线治疗;肝细胞癌的一线治疗;肝癌的辅助治疗;三阴性乳腺癌;三阴性乳腺癌的新辅助治疗;肾细胞癌; 宫颈癌的一线治疗。
恒瑞医药研发的卡瑞利珠单抗是国产四大经典PD-1抑制剂之一。也是国内PD-1抑制剂中获批适应症最多的药物,也有多项III期临床试验正在进行中。
卡瑞珠单抗也已纳入医保覆盖范围,将于2021年3月更新至最新医保报销目录。
四、替雷利珠单抗
产品名称:白泽安
批准的适应症:
1、于2019年12月27日获批,用于治疗至少接受过二线全身化疗的复发或难治性经典霍奇金淋巴瘤患者。
2、2020年4月20日获批用于PD-L1高表达的含铂化疗失败后新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌。我国尿路上皮癌免疫治疗的空白。
3、2021年1月14日获批与紫杉醇、卡铂联合用于局部晚期或转移性鳞状非小细胞肺癌的一线治疗。
4、2021年6月22日,联合培美曲塞和铂类化疗用于表皮生长因子受体(EGFR)突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可切除的局部一线治疗晚期或转移性非鳞状非小细胞肺癌()。
5、2021 年 6 月 22 日,批准用于先前治疗的不可切除的肝细胞癌 (HCC)。
替雷利珠单抗是国内首个获批用于治疗尿路上皮癌的PD-1单抗。
正在调查的主要适应症:
(上市申请):鼻咽癌;广泛期小细胞肺癌的一线治疗;食管鳞状细胞癌;尿路上皮癌的一线治疗。
(重点研究):MSI-H或dMMR实体瘤
(III期临床):非小细胞肺癌二线治疗;肝细胞癌的一线治疗;食管鳞状细胞癌的二线治疗;胃癌的一线治疗;食管鳞状细胞癌的一线治疗;非小细胞肺癌的三线治疗。
百济神州开发的替雷利珠单抗是国内四大经典PD-1抑制剂之一。
与、一样,也是PD-1抑制剂,实现了非驱动基因突变非小细胞肺癌一线治疗的全覆盖。
在治疗另一种重要的肺癌亚型小细胞肺癌方面,替雷利珠单抗也显示出良好的潜力。该药也在2021年3月新更新的医保目录中纳入医保报销范围。
五、片匹利木单抗
产品名称:阿尼可
批准的适应症:
复发和难治性经典霍奇金淋巴瘤
2021年8月5日,派姆单抗注射液获得国家药品监督管理局批准上市。成年患者。
重要指征:
(III期临床):鳞状非小细胞肺癌一线治疗;非鳞状非小细胞肺癌一线治疗(+化疗/+安罗替尼);肝癌的一线治疗;鼻咽癌的一线/三线治疗。
是我国康方生物自主研发的PD-1抑制剂,是我国上市的第五款国产PD-1抑制剂。
虽然这款药物上市较晚,但临床试验进展迅速,尤其是其国际化进程非常快。2018年,获得美国食品药品监督管理局(FDA)的新药临床试验批准(IND),允许对包括实体瘤在内的各种适应症进行临床试验。
六、司帕利珠单抗
产品名称:玉都
批准适应症:复发和难治性经典霍奇金淋巴瘤
(GLS-010),是2021年8月30日获批的第6个国产PD-1抑制剂,由宇恒生物研发,为全人源化单克隆抗体)。
值得一提的是,宇恒药业将在北美、欧洲、日本等部分地区的独家开发及商业化权独家授权给了美国生物公司。这意味着该药在国外的临床试验进程将由国外实力雄厚的药企推动,结果非常值得期待。
PD-L1 mAb 已发布
一、恩沃利单抗
品牌名称:恩维达
批准的适应症:
2021年11月24日,国家药品监督管理总局通过优先审评审批程序,有条件批准用于不可切除或转移性高微卫星不稳定性(MSI-H)或错配修复基因缺陷(dMMR)的诺瑞单抗()上市。 ) 成人晚期实体瘤患者,包括晚期结直肠癌患者、既往氟尿嘧啶、奥沙利铂、伊立替康治疗后疾病进展的胃癌患者,以及其他既往治疗后疾病进展且无满意替代治疗方案的晚期实体瘤患者。
是由先声药业、 和 联合开发的PD-L1单克隆抗体。是我国第一个自主研发的PD-L1抗体,也是世界上第一个皮下注射剂。PD-L1 抗体。
二、舒格利木单抗
产品名称:泽洁美
2021年12月21日,中国国家药品监督管理局批准舒格利单抗联合培美曲塞和卡铂用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性转移性患者的一线治疗非鳞状非小细胞肺癌,以及紫杉醇和卡铂联合用于转移性鳞状非小细胞肺癌患者的一线治疗。
舒格利木单抗是基石药业研发的PD-L1单克隆抗体,其获批是基于上海肺科医院周才存教授进行的-302研究结果。
此外, 治疗复发或难治性结外 NK/T 细胞淋巴瘤的关键 II 期研究近期也达到了主要终点;胃癌、食管鳞癌和淋巴瘤的注册研究也在积极推进中。
PD-L1 mAb申请上市:
三、首钢注射利木单抗
2021年10月28日,李氏制药厂旗下兆科药业PD-L1抑制剂舒卡木单抗注射液()的新药上市申请获国家药监局受理,用于治疗复发或转移性疾病。宫颈癌。
四、替木单抗
2021年11月19日,由科伦医药控股有限公司子公司科伦生物研发的PD-L1单克隆抗体四木单抗注射液(产品代码:KL-A167))提交上市许可)。该申请已被国家药品监督管理局药品审评中心受理。
五、阿德贝利木单抗
2022年1月19日,CDE官网显示,恒瑞医药PD-L1单克隆抗体及阿德贝利单抗上市申请获受理。这也是国内第五个申报上市的PD-L1单克隆抗体。
2021年10月27日,恒瑞医药公布了一项随机、双盲、安慰剂对照、多中心的阿德贝利木单抗(研发代码:SHR-1316)联合化疗一线治疗广泛期小细胞肺癌)。SHR-1316 III 期临床研究的主要终点结果达到了项目的预期目标。结果表明,与安慰剂联合化疗相比,SHR-1316联合化疗可显着延长患者的总生存期(OS)。(吉林省肿瘤医院程颖)中国医学科学院肿瘤医院教授与王杰教授共同研究)
从以上可以看出,国产PD-1/L1单克隆抗体的竞争已经达到了白热化的程度。无论是已经上市的药物,还是即将上市的药物,都显示出强大的实力,迅速推动了免疫疗法的升级换代。, 可以说是火光冲天,硝烟四起。
然而,这场战斗还远未结束。在大量单克隆抗体卷入混战的同时,最新的双抗体药物已经悄然上市,但也给单克隆抗体带来了巨大的挑战。本来就众多的单克隆抗体江湖变得更加复杂。
2021年9月24日,国家药品监督管理局正式受理康方生物研发的全球首个PD-1/CTLA-4双特异性抗体(研发代码:)上市申请,用于治疗复发或转移性宫颈癌。并获得优先审查。此外,齐鲁药业、康宁杰瑞、科伦药业的双抗体免疫治疗药物也在积极研发中,预计近期将进入审评程序。
总之,中国在抗肿瘤免疫治疗领域取得了惊人的进步。从第一个进入中国的进口药,到引进国产“四小龙”,从多个单克隆抗体药物进入临床到双抗体药物的研发,仅过去三年,各种国产免疫治疗药物如雨后春笋般涌现,覆盖了各类癌症治疗领域。
随着众多国产药物的强势崛起,国产免疫治疗已形成暂时以“四小龙”为主的大格局,多种药物齐头并进。随着时间的推移,很难说“四小龙”能走多远。谁能在残酷的竞争中继续获胜,称霸江湖,最终成为免疫疗法的霸主,还远未可知。
(本文为肿瘤免疫治疗药物开发介绍,不作为治疗依据,临床必要时请咨询肿瘤科医务人员)
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话