欢迎光临吉康旅!
摘要:胶质瘤基因结果的意义是什么?选择哪些分子靶向药物?
本文内容
0. 胶质瘤分子遗传学检测结果解读
1. 抗血管生成分子靶向药物
2. 抗表皮生长因子受体(EGFR)分子靶向药物
3. 免疫治疗分子靶向药物
4. 柠檬酸脱氢酶同工酶 IDH 突变分子靶向药物
5. 表观遗传学相关分子靶向药物
根据2012年中国肿瘤登记报告,我国脑及中枢神经系统恶性肿瘤死亡率为3. 87/10万,其中胶质瘤占中枢神经系统恶性肿瘤的81%。脑胶质瘤严重危害人们的健康。目前的治疗仍以手术为主,术后辅助放化疗,肿瘤恶性程度高,预后极差。随着分子肿瘤学研究的发展,2016年5月,世界卫生组织(WHO)发布了第四版(修订)中枢神经系统肿瘤分类,这是第一个整合组织学表型和基因型表型的中枢神经系统肿瘤分类。
胶质瘤分子标志物解读
近年来,神经肿瘤的分子病理学研究取得了重大进展,发现了一系列有助于胶质瘤临床诊断和预后的分子标志物。目前的 WHO 病理分级仍然依赖于肿瘤的形态学分级,然而,有充分证据表明,具有相同或相似组织学特征的胶质瘤可能具有不同的分子遗传背景,导致具有相同 WHO 分级差异的个体的预后更大。基于肿瘤遗传学水平的分子病理学分类可以更准确地判断临床预后;对于组织学上难以区分的混合性胶质瘤(少突星形细胞瘤和间变性少突星形细胞瘤),有助于明确诊断和分类。此外,
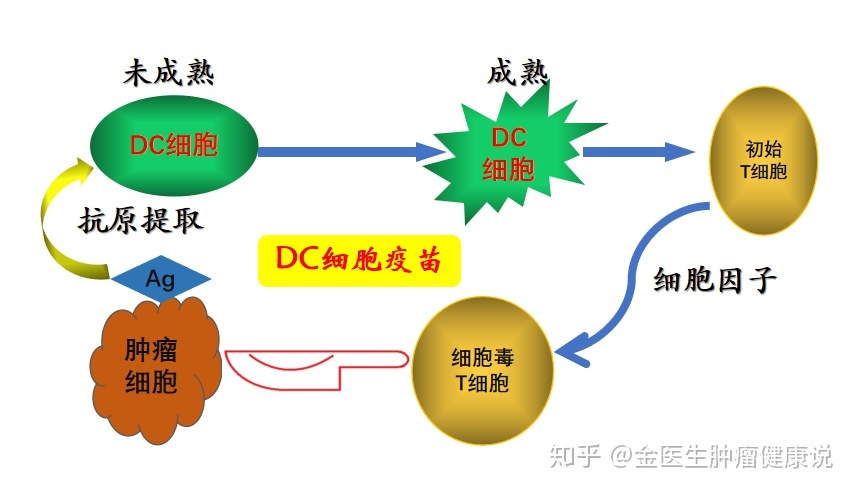
图:11个胶质瘤分子标志物列表
图:胶质瘤常用检测分子汇总及其意义
近10年来,胶质瘤的基础和临床研究取得重大突破,进一步了解胶质瘤的分子生物学特征。病理生理学和发病机制的奥秘。除了种族、性别、年龄、生活习惯等临床常见因素外,重要分子标志物的筛选对于临床胶质瘤的诊断、治疗和预后具有深远意义。
图:胶质瘤分子遗传学诊断示意图
1 抗血管生成分子靶向药物
HGG的一个显着病理特征是其血管生成,这归因于血管内皮生长因子(VEGF)在肿瘤及周围组织中的高表达,尤其是在正常组织中几乎不表达的VEGF-A。这似乎使抗血管生成药物,尤其是那些拮抗 VEGF 信号通路的药物,成为治疗 HGG 的理想靶点。实践证明,多种抗血管生成药物,如VEGF受体酪氨酸激酶抑制剂、整合素抑制剂等,在III期临床研究中均不能实现胶质母细胞瘤(GBM)治疗后的改善。患者总生存期 (OS) 的目标。然而,VEGF受体酪氨酸激酶抑制剂(贝伐单抗)作为一种重组人单克隆IgG抗体,可以特异性拮抗VEGF,尤其是VEGF-A,并阻断 VEGF-A 和 VEGF 受体 (VEGF-A)。-1,VEGF-R2)结合减少血管生成,从而下调血管生成并抑制肿瘤生长。使用贝伐单抗后,复发性GBM患者的影像学表现明显改善,糖皮质激素的使用明显减少,无进展生存期(PFS)提高,上述结果已在多个III期临床中得到验证学习。虽然没有 OS 益处,但它仍然被美国食品和药物管理局批准用于复发性 GBM。在一项 III 期临床研究中,入组了 921 名新发 GBM 患者,使用贝伐单抗显示 OS 没有改善,但 PFS 显着延长(10.6 个月 vs 6.2 个月) . 尤其,该研究的事后亚组分析表明,患有野生型柠檬酸脱氢酶同工酶 IDH 的新发 GBM 患者使用贝伐单抗延长了 OS4. 由于 GBM 缺乏标准化的表型分组,这一观察结果需要进一步的前瞻性研究来证实实验前的患者和分析的事后性质。2016年WHO明确将GBM按基因型和表型分类为IDH野生型和IDH突变型后,或许可以根据上述基因型对新的GBM患者进行分组,再次用贝伐单抗进行III期临床研究。前瞻性研究结果可能会让人们大吃一惊。由于在实验前缺乏对 GBM 患者的标准化表型分组以及分析的事后性质,这一观察结果需要进一步的前瞻性研究来证实。2016年WHO明确将GBM按基因型和表型分类为IDH野生型和IDH突变型后,或许可以根据上述基因型对新的GBM患者进行分组,再次用贝伐单抗进行III期临床研究。前瞻性研究结果可能会让人们大吃一惊。由于在实验前缺乏对 GBM 患者的标准化表型分组以及分析的事后性质,这一观察结果需要进一步的前瞻性研究来证实。2016年WHO明确将GBM按基因型和表型分类为IDH野生型和IDH突变型后,或许可以根据上述基因型对新的GBM患者进行分组,再次用贝伐单抗进行III期临床研究。前瞻性研究结果可能会让人们大吃一惊。并再次用贝伐单抗进行 III 期临床研究。前瞻性研究结果可能会让人们大吃一惊。并再次用贝伐单抗进行 III 期临床研究。前瞻性研究结果可能会让人们大吃一惊。
图:目前针对胶质瘤的分子靶向药物总结
2 抗表皮生长因子受体(EGFR)分子靶向药物
EGFR与配体结合后,磷酸化酪氨酸激酶并激活其下游信号通路,从而引起细胞增殖和迁移。表皮生长因子受体Ⅲ型突变使酪氨酸残基磷酸化,产生鸟嘌呤核苷酸的细胞交换因子,导致ⅢGBM细胞生长。因此,针对EGFR扩增和重排的分子靶向药物可能是治疗GBM的理想药物之一。抗EGFR扩增药物分为两类:单克隆抗体(mAb)药物(MA)、EGFR小分子酪氨酸激酶抑制剂(TKI);抗重排药物主要是疫苗制剂。
2.1 个 mAb
单克隆抗体包括西妥昔单抗、尼妥珠单抗和EDM /mAb 425。它作用于GBM细胞表面的跨膜受体,或作用于GBM细胞外生长因子,阻断其配体活性,诱导细胞凋亡和抗血管生成,从而达到抑制GBM细胞的作用。临床上,单克隆抗体常与放疗或化疗联合使用,以发挥其特异性的指导作用。2012年,美国临床肿瘤学会(ASCO)公布了尼妥珠单抗治疗GBM的I期临床研究结果。治疗组患者采用标准放化疗联合尼妥珠单抗治疗,对照组患者采用标准放化疗。治疗组的中位生存时间(MOS)为22. 3个月,对照组为19。6个月;亚组分析进一步表明,EGFR 扩增且无甲基转移酶启动子甲基化的患者获益更多。其他几项使用尼妥珠单抗治疗胶质瘤的 I 期和 II 期临床研究也产生了类似的发现。因此,临床上可将尼妥珠单抗加入新发GBM患者的放化疗中,以取得更好的疗效。一项西妥昔单抗治疗复发性GBM患者的II期临床研究结果表明,无论是否伴随EGFR扩增,西妥昔单抗在PFS和OS方面均无益处。其他几项使用尼妥珠单抗治疗胶质瘤的 I 期和 II 期临床研究也产生了类似的发现。因此,临床上可将尼妥珠单抗加入新发GBM患者的放化疗中,以取得更好的疗效。一项西妥昔单抗治疗复发性GBM患者的II期临床研究结果表明,无论是否伴随EGFR扩增,西妥昔单抗在PFS和OS方面均无益处。其他几项使用尼妥珠单抗治疗胶质瘤的 I 期和 II 期临床研究也产生了类似的发现。因此,临床上可将尼妥珠单抗加入新发GBM患者的放化疗中,以取得更好的疗效。一项西妥昔单抗治疗复发性GBM患者的II期临床研究结果表明,无论是否伴随EGFR扩增,西妥昔单抗在PFS和OS方面均无益处。
2.2 小分子酪氨酸激酶抑制剂
TKI包括吉非替尼、厄洛替尼、阿法替尼、卡纳替尼和拉帕替尼等。这些药物进入细胞并与靶分子结合,抑制下游磷酸化,并特异性干扰靶蛋白酶的活性。从而阻断细胞信号传递,达到抑制肿瘤增殖的目的。TKI已用于治疗EGFR突变的肺腺癌并取得了明显的疗效,但目前的研究未能证明TKI对GBM有效,原因可能是血脑屏障的存在不利于药物进入颅内GBM细胞发挥作用;一个原因可能是缺乏 EGFR 敏感基因突变以及 GBM 中存在其他替代途径。
2.3 重新排列的疫苗配方
该疫苗含有 III肽,可针对表达 III重排的GBM产生特异性免疫反应,从而产生治疗效果。在新发GBM患者的I期和II期临床研究中,以替莫唑胺(TMZ)作为标准对照,疫苗联合TMZ作为治疗组。PFS 为 10-15 个月,MOS 分别为 22-26 个月。在一项 II 期试验中,该疫苗与贝伐单抗联合使用时,对表达该突变的 GBM 患者产生了特异性免疫反应,延长了这些患者的 6 个月无进展生存期和中位生存期,PFS 为 27%在疫苗联合贝伐单抗治疗组和贝伐单抗单药对照组中为 11%;联合治疗组 MOS 为 12 个月,贝伐单抗单药对照组 MOS 为 8 个月。8个月。这些I期和II期临床研究结果都表明,重组疫苗制剂可能是GBM靶向治疗的新方向。然而, 的 III 期临床研究结果表明,疫苗与 TMZ 联合治疗具有新 GBM 突变的患者并不能改善 OS。然而,EGFR仍然是一种很有前途的GBM分子靶向治疗药物,研究人员使用不同的方法来提高EGFR靶向治疗的疗效。ABT-414是一种强效微管抑制剂(单甲基 F)和一种针对肿瘤选择性EGFR表位的单克隆抗体(仅在EGFR野生型过表达肿瘤和突变表达肿瘤中发现)的结合物,它对靶向药物具有高选择性和清除GBM 在临床前研究和 I 期临床研究中的细胞毒性。是一种具有很高应用价值的新型药物。阶段临床研究。
3 免疫治疗的分子靶向药物
3.1 主动免疫疗法
主动免疫治疗一般使用肿瘤疫苗作为免疫原,包括树突状细胞疫苗、短肽疫苗、肿瘤细胞疫苗和基因疫苗。树突状细胞 (DC) 是专职抗原呈递细胞。DC 将肿瘤抗原呈递给主要组织相容性复合物 (MHC),以形成 T 细胞识别的抗原-MHC 复合物。在 GBM 中输注 DC 的临床研究正在进行中。载有热休克蛋白 (HSP) 的 DC 疫苗称为 HSP 疫苗,这些伴侣蛋白在免疫反应中起到稳定和转运蛋白的作用。HSP 疫苗可以将抗原呈递给 I 类和 II 类 MHC,激活 CD4+ T 辅助细胞和 CD8+ 细胞毒性 T 淋巴细胞,多价 HPV 复合物可以呈递各种类型的抗原,并有望防止抗原逃逸。在两项开放标签的 II 期临床研究中,-96 疫苗的耐受性和安全性在复发性 GBM 患者中是可以接受的。HSP疫苗在胶质瘤患者的治疗中取得了一定的抗肿瘤作用。在体外,细胞因子诱导和扩增的自然杀伤细胞 (NK) 同时表达 CD3 和 CD56 作为核心,具有抗肿瘤特性,称为细胞因子诱导杀伤细胞 (CIK),并形成负载 CIK 的 DC。CIK-DC 疫苗。CIK-DC疫苗在治疗复发性胶质瘤的临床研究中也取得了一定的成果。GBM细胞相关肽疫苗治疗复发性GBM患者,粘液瘤病毒转染的胶质瘤细胞疫苗治疗荷癌小鼠可延长MOS。HSP疫苗在胶质瘤患者的治疗中取得了一定的抗肿瘤作用。在体外,细胞因子诱导和扩增的自然杀伤细胞 (NK) 同时表达 CD3 和 CD56 作为核心,具有抗肿瘤特性,称为细胞因子诱导杀伤细胞 (CIK),并形成负载 CIK 的 DC。CIK-DC 疫苗。CIK-DC疫苗在治疗复发性胶质瘤的临床研究中也取得了一定的成果。GBM细胞相关肽疫苗治疗复发性GBM患者,粘液瘤病毒转染的胶质瘤细胞疫苗治疗荷癌小鼠可延长MOS。HSP疫苗在胶质瘤患者的治疗中取得了一定的抗肿瘤作用。在体外,细胞因子诱导和扩增的自然杀伤细胞 (NK) 同时表达 CD3 和 CD56 作为核心,具有抗肿瘤特性,称为细胞因子诱导杀伤细胞 (CIK),并形成负载 CIK 的 DC。CIK-DC 疫苗。CIK-DC疫苗在治疗复发性胶质瘤的临床研究中也取得了一定的成果。GBM细胞相关肽疫苗治疗复发性GBM患者,粘液瘤病毒转染的胶质瘤细胞疫苗治疗荷癌小鼠可延长MOS。CIK-DC 疫苗。CIK-DC疫苗在治疗复发性胶质瘤的临床研究中也取得了一定的成果。GBM细胞相关肽疫苗治疗复发性GBM患者,粘液瘤病毒转染的胶质瘤细胞疫苗治疗荷癌小鼠可延长MOS。CIK-DC 疫苗。CIK-DC疫苗在治疗复发性胶质瘤的临床研究中也取得了一定的成果。GBM细胞相关肽疫苗治疗复发性GBM患者,粘液瘤病毒转染的胶质瘤细胞疫苗治疗荷癌小鼠可延长MOS。
3.2 被动免疫疗法
被动免疫疗法包括过继性细胞免疫疗法和体液免疫疗法。淋巴因子激活的杀伤细胞、NK、CIK、外周血记忆淋巴细胞、淋巴结中的肿瘤浸润淋巴细胞、肿瘤浸润淋巴细胞和肿瘤抗原刺激的淋巴细胞在临床研究中均未显示出显着效果。另一方面,用肿瘤相关抗原和嵌合抗原受体 (CART) 修饰的淋巴样 T 细胞仅识别单一抗原,并且可以在不影响共刺激因子或类别的情况下杀死肿瘤靶细胞。由重组人白细胞介素 13 受体 α 2 ( α 2 ) 靶向的 MHC I 导致小鼠颅内肿瘤完全缓解,在临床前研究中没有复发。在 I 期临床研究中,-CART 是安全的。与 CD28 共刺激物和 CD3 连接的第二代 α2-CART 细胞克隆正在等待试验,预计将具有卓越的疗效。最近的研究还表明,靶向 III 的细胞在 CART GBM 中起作用。靶向细胞上抗原和靶向GBM EGFR GBM细胞微环境的治疗方法广义上是体液免疫治疗,临床研究已取得一定成果。
3.3免疫调节疗法
正常情况下,胶质瘤患者处于强烈的免疫抑制状态,这归因于患者体内髓源性抑制细胞(MDSC)、CD3 + 、 和调节性CD4 + + T细胞的比例增加。因此,在细胞因子水平降低CTLA等抑制因子,激活包括淋巴细胞在内的全身免疫系统,称为免疫调节疗法。免疫调节治疗的代表性药物包括检查点抑制剂、CTLA-4单克隆抗体,如易普利姆玛;程序性细胞死亡单克隆抗体等药物。这些药物从根本上解除抑制细胞活化的细胞因子因子,激活机体细胞的免疫反应杀灭肿瘤,起到治疗作用。在治疗黑色素瘤脑转移方面取得了一定的效果,这提示了以下两种可能:一种是可以通过血脑屏障,另一种是颅内肿瘤细胞可能高表达。此外,CTLA-4 下调和亚群也在研究中。未来,调节MDSC和Treg亚群的疫苗或可用于缓解胶质瘤引起的免疫微环境抑制状态,使机体自身的淋巴细胞更有效地杀伤肿瘤细胞,从而改善患者的OS。因此,这些免疫治疗分子靶向药物在胶质瘤治疗中具有广阔的应用前景,值得进一步研究。一是可以通过血脑屏障,二是颅内肿瘤细胞可能高表达。此外,CTLA-4 下调和亚群也在研究中。未来,调节MDSC和Treg亚群的疫苗或可用于缓解胶质瘤引起的免疫微环境抑制状态,使机体自身的淋巴细胞更有效地杀伤肿瘤细胞,从而改善患者的OS。因此,这些免疫治疗分子靶向药物在胶质瘤治疗中具有广阔的应用前景,值得进一步研究。一是可以通过血脑屏障,二是颅内肿瘤细胞可能高表达。此外,CTLA-4 下调和亚群也在研究中。未来,调节MDSC和Treg亚群的疫苗或可用于缓解胶质瘤引起的免疫微环境抑制状态,使机体自身的淋巴细胞更有效地杀伤肿瘤细胞,从而改善患者的OS。因此,这些免疫治疗分子靶向药物在胶质瘤治疗中具有广阔的应用前景,值得进一步研究。调节MDSC和Treg亚群的疫苗可用于缓解胶质瘤引起的免疫微环境抑制状态,使机体自身淋巴细胞更有效地杀伤肿瘤细胞,从而改善患者的OS。因此,这些免疫治疗分子靶向药物在胶质瘤治疗中具有广阔的应用前景,值得进一步研究。调节MDSC和Treg亚群的疫苗可用于缓解胶质瘤引起的免疫微环境抑制状态,使机体自身淋巴细胞更有效地杀伤肿瘤细胞,从而改善患者的OS。因此,这些免疫治疗分子靶向药物在胶质瘤治疗中具有广阔的应用前景,值得进一步研究。
4 柠檬酸脱氢酶同工酶IDH突变分子靶向药物
IDH分为IDH1、IDH2、IDH3和IDH,是哺乳动物细胞柠檬酸循环过程中的一种代谢酶,通常催化异柠檬酸氧化脱羧为酮戊二酸。胶质瘤中 IDH1 突变、突变频率较低和 IDH2 突变的患者比 IDH 野生型患者的预后更好。IDH突变被认为是胶质瘤起源的重要因素之一,或许可以用特异性抑制剂阻断这一过程,从而有效治疗胶质瘤。因此,突变研究是胶质瘤IDH诊断、治疗和预后评估的重点和热点之一。IDH1 的突变会增加细胞内 2-羟基戊二酸 ( ) 的含量,这被称为胶质瘤 2HG 2HG 起源的潜在生物标志物,但这一说法仍未得到证实。2HG 不仅抑制酮戊二酸双加氧酶,还抑制 α14 缺氧诱导因子、组蛋白去甲基化酶和甲基胞嘧啶 5-羟化酶,导致全细胞低甲基化。研究发现,在体外胶质瘤细胞试验和 IDH1 IDH1 胶质瘤小鼠动物模型中,使用突变体特异性抑制剂降低了 的含量,并阻止了肿瘤的形成或生长。此外,突变型胶质瘤细胞中的辅酶显着降低了IDH NAD+,使用烟酰胺磷酸核糖转移酶()抑制剂提高水平可显着提高胶质瘤小鼠NAD+ IDH1的存活率。因此,抑制剂作为潜在的胶质瘤靶向治疗药物值得进一步研究。此外,临床前研究表明,短肽疫苗R132 IDH1疫苗,作用于位点突变,有一定疗效,GBM也正在开展相关临床研究。由于基因突变是胶质瘤的起源之一,广泛存在于IDH弥漫性胶质瘤中,目前尚无有效的分子靶向药物,是未来研究的重点方向之一。
5 表观遗传相关分子靶向药物
表观遗传学通常是指在细胞序列中没有DNA变化的情况下基因表达和功能的变化,从而导致可遗传的表型。胶质瘤细胞甲基化是比较深入的研究领域之一。甲基化是一种由酶蛋白介导的化学修饰,可选择性地将甲基基团添加到蛋白质或 DNA RNA 中。甲基化后,核苷酸序列和组成没有改变,但细胞基因表达受到影响,并且随着细胞分裂而遗传。高甲基化表型可以改变细胞染色体拓扑结构并改变多个基因的表达,包括潜在的癌基因。研究表明,突变的高甲基化表型导致绝缘蛋白 IDH 从突变结合位点分离,正常静止的血小板衍生的 IDH 生长因子受体癌基因启动子与突变绝缘体相连,该绝缘体改变 的构象,形成复合的、激活的 IDH。,从而允许肿瘤细胞生长。使用去甲基化药物后,绝缘体恢复正常功能可抑制突变星形细胞瘤细胞的生长。需要指出的是,IDH 在儿童和成人 GBM 的基因型、表观遗传变化方面是不同的。儿童最常见的临床表现是弥漫性中线胶质瘤,2016年WHO将其分类为突变-突变型弥漫性中线胶质瘤。结合IDH1突变、突变和突变,儿童可分为4个亚组:IDH1突变、突变、突变组和 H3/IDH1 野生型组。
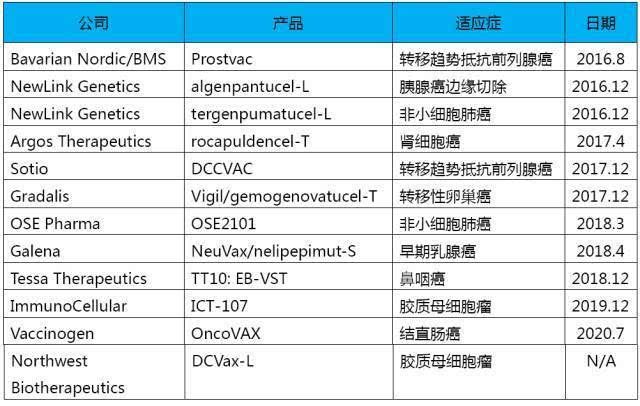
6 其他类型的分子靶向药物
多核糖聚合酶抑制剂,可干扰磷酸酶和 ADP 张力蛋白同源蛋白缺陷型肿瘤的生长;核转录因子kB抑制剂,信号转导和转录激活剂抑制剂,3干扰肿瘤细胞有丝分裂纺锤体雷帕霉素靶点(MTOR)是否发挥GBM作用的机制仍有待阐明,对MTOR治疗的抑制作用正在研究中。
总结
抗血管生成、表皮生长因子受体、表皮生长因子受体3型突变、免疫治疗、柠檬酸脱氢酶同工酶IDH突变、表观遗传相关等类型的分子靶向药物是未来临床治愈的胶水其中贝伐单抗已用于治疗复发性胶质母细胞瘤(GBM),新诊断的GBM患者在放化疗中加入尼妥珠单抗有望取得更好的疗效。治疗胶质瘤的各种疫苗中,CART细胞可以直接杀伤肿瘤细胞,而程序性细胞死亡单克隆抗体等免疫调节药物可以使机体的淋巴细胞恢复对肿瘤细胞的杀伤功能。IDH1突变和表观遗传突变引起的GBM尚无有效的分子靶向药物;儿童基因型
参考:
中国胶质瘤分子诊治指南.
分子靶向药物治疗胶质瘤的研究进展
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话