欢迎光临吉康旅!
感谢您的参与和大力支持。
贝伐珠单抗注射液生物类似药临床试验指南
(征求意见稿)
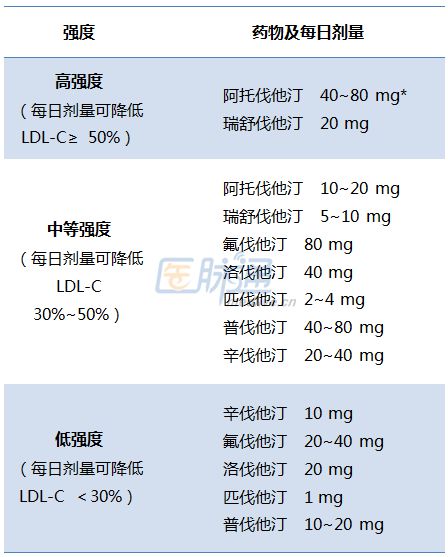
一、概述
贝伐珠单抗是基因泰克公司最初开发并由中国仓鼠卵巢细胞表达的重组人源化IgG1单克隆抗体,特异性靶向游离血管内皮生长因子(VEGF),阻断游离VEGF及其受体(Flt-1和KDR)结合抑制肿瘤血管生成并起到抗肿瘤作用。贝伐单抗于 2004 年 2 月首次获得美国 FDA 批准,联合以氟尿嘧啶为基础的化疗方案用于治疗初治的转移性结直肠癌,其商品名为 [1]。目前已被美国FDA批准用于晚期非鳞状非小细胞肺癌(非)、转移性结直肠癌、复发性胶质母细胞瘤、转移性肾癌、宫颈癌和卵巢癌。适应症[2]。2010年2月,中国食品药品监督管理总局批准进口注册,适应症为转移性结直肠癌,后续将增加非鳞状癌适应症。截至目前,已有7个肿瘤适应症在全球100多个国家和地区获批,是当前抗肿瘤生物类似药的研发热点。
肿瘤适应症广泛,专利陆续到期(2019年欧洲专利,2017年美国专利)[3]。目前,国内外多家药企正在研发生物类似药,生物类似药已获批[4-5]。为更好地推动生物类似药的研发,根据国家药品监督管理局(NMPA)药品审评中心发布的《生物类似药研制与审评技术指南(试行)》[6],结合安维在为规范和促进我国贝伐单抗生物类似药的研发,本技术指南将从综述的角度进行探讨。.
二、贝伐单抗生物类似药的临床研究策略
生物类似药研发的总体思路是通过对比试验来证明其与阿瓦斯汀的相似性。采取循序渐进的策略,分阶段开展药学、药理毒理和临床对照试验。根据初步比较试验的结果设计后续研究。
根据药理毒理初步对比结果,贝伐珠单抗生物类似药的临床研发、药理及药理毒理试验证明受试药物与阿瓦斯汀相似,药代动力学按路径进行生物类似药。比较试验和临床安全性和有效性比较试验。鉴于国内外阿瓦斯汀批准的适应症存在差异,临床安全性和有效性对比试验中可能出现以下四种选择:
①选择国内批准的适应症,开展与阿瓦斯汀“头对头”比较的等效性研究。目前大部分选择新治疗的转移性非鳞屑,主要研究终点是相对敏感的指标客观缓解率(e,ORR)。
②选择国内批准的适应症,但不与“头对头”比较,而是与以外的其他可选标准治疗比较,具有无进展生存期(val,PFS)或总生存期(,OS)等常见临床终点是主要终点。
③选择国外获批但国内未获批的适应症开展临床研究,如肾癌、卵巢癌等,与目前针对目标适应症的标准治疗方案进行比较,以PFS或OS等常见临床终点为指标主要终点。
④选择国内外未批准的适应症进行临床研究,如视网膜黄斑变性。
针对上述情况,1法是目前研发企业最常选择的路径,是贝伐单抗生物类似药推荐的临床开发策略。按照此路径完成单一适应症的研究,即可获得技术评审。外推阿瓦斯汀在中国批准的其他适应症(具体方案设计详见后文)。根据②③④的研发策略,无法证明相似性,因为与阿瓦斯汀相比并非“头对头”,②③④不能支持贝伐单抗生物类似药的临床评价。
三、贝伐珠单抗临床研究设计要点
生物类似药的临床对比研究通常从药代动力学(PK)和/或药效学对比试验研究开始,然后根据相似性评价结果考虑后续的临床有效性对比试验。研究设计应以证明试验药物与原研究药物的相似性为目的,在保证科学评价的前提下简化研究。由于阿瓦斯汀缺乏合适的药效终点,目前国内外贝伐单抗生物类似药的临床研究多采用药代动力学对比研究和临床安全性和有效性对比研究。
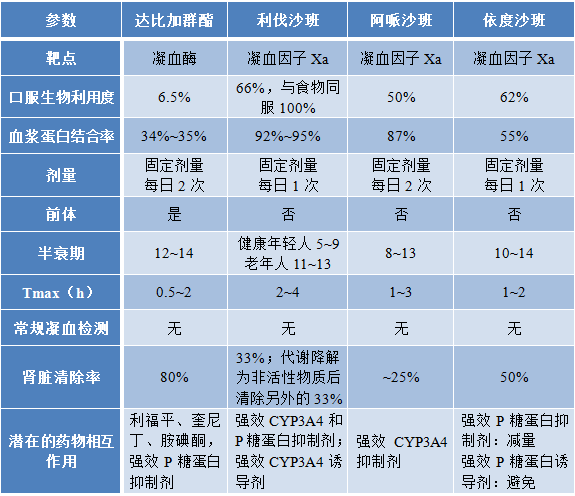
1.PK对比研究
实验设计:参考一般生物等效性研究设计,结合阿瓦斯汀较长的半衰期(18-20天),以及免疫原性等特点。交叉设计不适用于评估其生物等效性。推荐采用随机、双盲、阿瓦斯汀平行对照试验设计。
单剂量PK比较研究容易比较组间差异,推荐单剂量PK比较研究。
多剂量PK比较研究不如单剂量PK比较研究敏感,但可以反映受试药剂量和时间相关的免疫原性,以及酶介导、靶介导、FcRn-介导及其他相关药物清除。建议在完成单剂量 PK 比较研究以确定相似性后,在临床有效性比较研究期间应调查多剂量的 PK 特征。免疫原性的评价应贯穿整个临床比较研究。
研究人群:健康志愿者是理想的同质人群,可以更敏感地评估受试药物与阿瓦斯汀之间的 PK 差异。由于研究的主要目的是调查PK的相似性,因此只能选择健康的男性志愿者。肿瘤患者由于自身基础疾病的影响,不利于PK差异的比较和评价,因此不建议选择肿瘤患者进行PK比较研究。
参考药物来源:在临床研究中,应尽可能选择中国上市产品作为参考药物。如选用我国批准进口注册以外来源的参比药,应在临床试验开始前提供或进行不同来源的原研药之间的可比性证据。不同来源原研药的比较研究。
剂量和给药途径:PK比较研究旨在确认PK的相似性,不需要临床推荐的剂量。在1mg·kg-1~10mg·kg-1的剂量范围内,阿瓦斯汀的药代动力学呈线性特征[2],因此可在此范围内选择剂量。如果选择健康受试者,从保护受试者的角度考虑,应在检测方法允许的最低定量下限内尽可能选择较低的剂量。同时,与测试药物和阿瓦斯汀之间的差异相比,较低的剂量可能更敏感。因此,单剂量 PK 比较研究的推荐剂量为 1 mg·kg-1。由于方法学因素,3mg·kg-1也是可以接受的。给药途径为静脉给药,与阿瓦斯汀一致。给药时应注意控制输液速度,保持给药时间一致,以利于相似性评价。
终点指标和临界值:PK比较研究的主要终点指标的选择是等效性评价的关键。根据口服固体剂型相关指南[7],曲线下面积(AUC0-∞)和峰浓度(Cmax)是判断口服固体剂型生物等效性的主要参数。然而,在生物类似药的等效性评价中,是否选择AUC0-t或AUC0-∞作为终点仍存在争议。FDA 在其生物类似药指南中倾向于选择 AUC0-∞ 作为静脉给药的主要研究终点。由于AUC0-t是通过实测值计算的,考虑到生物类似药PK特性与实际研究过程中采血点设计的相关性,我们推荐 AUC0-t 作为主要的研究终点指标。AUC0-∞ 和 Cmax 用作比较分析的次要研究终点。建议当量限值设置为 80%-125%。
样本量:样本量是根据设定的等效阈值(80%-125%)、置信区间(90%)、功效(通常在80%以上)等参数计算的,应考虑的PK变异,建议开发者根据自身产品情况和研发目标适当扩大样本量,防止后续分析不充分。
2.效度对比研究
试验设计:临床有效性比较试验研究应遵循随机、双盲、平行对照的等效设计,以阿瓦斯汀为对照。
研究人群:应根据阿瓦斯汀的临床试验数据和批准的适应症选择最能反映临床疗效的人群。贝伐珠单抗目前在中国获批的适应症是“与氟尿嘧啶类化疗药物联合用于治疗转移性结直肠癌患者;联合含铂化疗一线治疗不可切除的晚期、转移性或复发性非鳞状细胞患者”[2]。贝伐珠单抗联合含铂化疗开展了多项大规模随机对照研究,并且可以获得比较多的参考疗效数据,包括在中国注册的卡铂联合紫杉醇临床试验[8]。建议选择转移性或复发性非鳞状细胞患者作为研究人群,这也是目前国内外研究产品使用的研究人群。在我国新治疗的非鳞状人群中,EGFR等驱动基因突变的频率高于白种人[9],驱动基因突变的患者应首先接受相应的靶向药物治疗[10],全球研究人群多为非亚洲人 驱动基因突变率低。今后在我国开展的贝伐单抗生物类似药疗效对比研究,必须符合肺癌临床诊治要求,排除驱动基因突变患者。这也是目前国内外研究产品使用的研究人群。在我国新治疗的非鳞状人群中,EGFR等驱动基因突变的频率高于白种人[9],驱动基因突变的患者应首先接受相应的靶向药物治疗[10],全球研究人群多为非亚洲人 驱动基因突变率低。今后在我国开展的贝伐单抗生物类似药疗效对比研究,必须符合肺癌临床诊治要求,排除驱动基因突变患者。这也是目前国内外研究产品使用的研究人群。在我国新治疗的非鳞状人群中,EGFR等驱动基因突变的频率高于白种人[9],驱动基因突变的患者应首先接受相应的靶向药物治疗[10],全球研究人群多为非亚洲人 驱动基因突变率低。今后在我国开展的贝伐单抗生物类似药疗效对比研究,必须符合肺癌临床诊治要求,排除驱动基因突变患者。EGFR等驱动基因突变的频率高于白种人[9],驱动基因突变的患者应首先接受相应的靶向药物治疗[10],全球研究人群大多为非亚洲人的驱动基因突变率低。今后在我国开展的贝伐单抗生物类似药疗效对比研究,必须符合肺癌临床诊治要求,排除驱动基因突变患者。EGFR等驱动基因突变的频率高于白种人[9],驱动基因突变的患者应首先接受相应的靶向药物治疗[10],全球研究人群大多为非亚洲人的驱动基因突变率低。今后在我国开展的贝伐珠单抗生物类似药疗效对比研究,必须符合肺癌临床诊治要求,排除驱动基因突变患者。
虽然结直肠癌适应症在中国也已获批,但支持在中国注册的临床试验使用贝伐单抗联合改良伊立替康、5-氟尿嘧啶和亚叶酸。目前的转移性疾病直肠的推荐治疗方案已改为/与西妥昔单抗联合(推荐用于具有Ras基因的野生型患者)或//与贝伐单抗联合。不同联合方案中贝伐珠单抗的给药剂量也不同。因此,新方案下可参考的中国人群疗效数据有限。而且,阿瓦斯汀对转移性结直肠癌缓解率的提高低于肺癌,难以开展等效性研究。如选择结直肠作为目标研究人群。建议在开展研究前与管理部门就人群选择、联合化疗方案、研究终点、等效临界值的重点研究设计等进行沟通。
剂量方案/剂量:可以通过选择参考药物剂量范围内的剂量来进行剂量选择。不同适应症的不同组合,原产品的推荐用量不同。国内批准剂量为大肠癌适应症5 mg·kg-1,每2周一次,适应症15 mg·kg-1,每3周一次。如果选择作为研究人群,则必须选择15mg·kg-1,每3周一次,与国内批准的阿瓦斯汀剂量一致。
研究终点:ORR 目前被普遍接受为主要终点。国内外贝伐珠单抗生物类似药治疗肺癌的III期临床试验均以ORR为主要终点。
研究文献表明,单用含铂化疗时,4个周期化疗和继续化疗直至进展与ORR相似,含铂化疗周期越多不能提高ORR[11-12]。在日本进行的一项联合使用化疗和贝伐单抗的临床研究中,缓解的中位时间为 6 周。国内晚期非小细胞肺癌专家共识提出,4个周期后仍未缓解且病情稳定的患者推荐一线化疗。因此,一些申请人提议使用第 12 周的 ORR 作为主要疗效终点。考虑到第 12 周评估中收集的疗效数据缺乏成熟度,鉴于阿瓦斯汀联合化疗最敏感的ORR评估点缺乏证据,建议以第18周ORR作为主要的ORR分析时间点,并在第24周或更长时间收集ORR,以便进行更多比较来支持等价。同时,收集缓解持续时间 (DOR) 和 PFS 等次要终点作为支持。
截断值的选择和样本量的计算:目前国际学术界对候选药物组与参比药物组之间研究终点的差异(,RD)或比值(,RR)在计算时仍存在争议阈值。一般来说,RR和RD在大多数情况下是等价的,目前推荐使用RR计算来设置等价限度。
目前发表的比较贝伐珠单抗联合化疗和单纯化疗作为一线治疗的II/III期随机对照试验包括国外5项研究[13-18]和中国注册的临床试验[9]。临界值可以根据对符合筛选指标的研究进行荟萃分析得到的治疗效果置信区间的下限进行估计。FDA 2016年发布的一份文件提出[12],如果基于国外贝伐单抗的4项随机对照研究进行荟萃分析,发现等效限度为[0.7368,1. 3572],80% 的确定性,最小样本量估计为 608 个案例。在中国,可以考虑纳入贝伐单抗在中国转移性或复发性非鳞状细胞患者的注册临床研究数据。根据这个计算,可以得到一个合理的截止值。考虑到研究的样本量较小,设计和实施目前还没有排除EGFR等驱动基因突变,接受化疗的突变型和野生型患者的ORR差异尚不清楚。请权衡将研究纳入荟萃分析的偏差,以计算等效阈值。在讨论贝伐单抗生物类似药临床评价的技术要求时,推荐的临界值应设置为(0.75, 1/0.75). 如果前一阶段的PK比较研究数据表明生物类似药与参比药一致,那么用实际RR的90%置信区间来确定等效性是可以接受的。置信度由开发者根据产品自身的风险设定,通常不低。80%以内。根据以上参数,合理估计样本量。根据全球发展战略,需要考虑满足不同监管部门的要求。样本量是合理估计的。根据全球发展战略,需要考虑满足不同监管部门的要求。样本量是合理估计的。根据全球发展战略,需要考虑满足不同监管部门的要求。
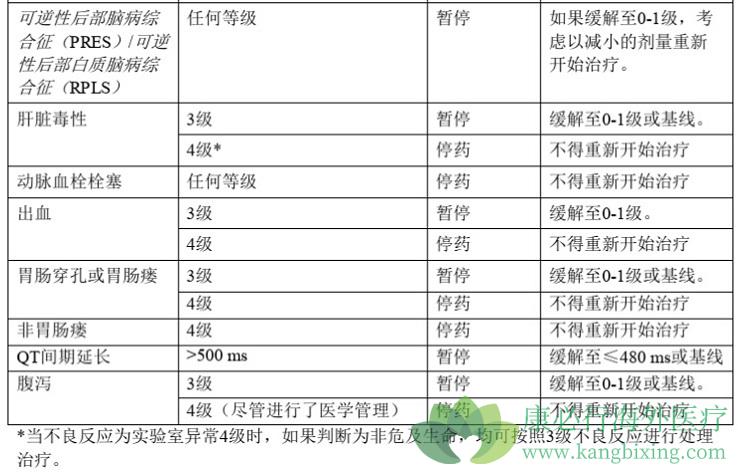
3.安全性和免疫原性研究
免疫原性研究是贝伐单抗生物相似性的重要研究项目,应贯穿整个研发过程。阿瓦斯丁的免疫原性很低。目前可获得的阿瓦斯汀免疫原性数据表明:在结肠癌辅助治疗的临床试验中,2233名可评估患者中有14名通过化学发光检测。患者(0.63%)因治疗导致抗贝伐珠单抗抗体检测呈阳性。在这 14 名患者中,3 名患者通过酶联免疫吸附试验检测出抗贝伐单抗中和抗体阳性 [2]。这些抗贝伐单抗抗体的临床意义尚不清楚。免疫原性检测结果与检测方法的敏感性和特异性高度相关,可能受以下因素影响:血样处理、采样时间、联合用药和合并疾病。由于上述原因,将抗贝伐单抗抗体的发生率与针对其他药物的抗体的发生率进行比较可能会产生误导。基于上述有限的内容和文献,结合抗药抗体出现延迟的经验,建议至少进行45周的免疫原性比较研究。免疫原性比较研究可以在有效性比较试验中进行。当受试药物的免疫原性尚不明确时,完成预设的疗效终点观察后,
安全性比较试验也在药代动力学、药效学和/或有效性比较试验中进行,以观察和比较不良反应的类型、严重程度和发生率,尤其是阿瓦斯汀反应的重要不良反应。建议提供具有足够长观察期的安全信息,以充分暴露受试药物的潜在风险。结合免疫原性比较的考虑,建议在完成主要疗效终点观察后至少收集一年单药维持治疗的安全性数据,以及2年的生存随访数据。
四、总结
贝伐珠单抗生物类似药的临床相似性研究需要考虑阿瓦斯汀产品的特点,遵循生物类似药临床相似性评价的一般规则,进行有针对性的设计和研究。生物类似药临床研究的设计和评价原则均应以验证候选药物与原研药的相似性为目的,并应在合理的科学基础上进行简化。鼓励研发企业与管理部门之间的交流,共同探索更科学、更高效的研究设计。
参考:
[1] 食品和药物管理局。[EB/OL]。食品药品监督管理局。
[2] FDA.[EB/OL]。食品药品监督管理局。
[3] A. 可以下一个吗?[J]. Nat Rev 药物。2012, 11(6):426-428.
[4] FDA... FDA。
[5] FDA... FDA。
[6] 国家药品监督管理局。生物类似药开发与评价技术指南(试行)。[EB/OL]。北京:国家食品药品监督管理局。
[7] 国家药品监督管理局。以药代动力学参数为终点评价指标的化学仿制药人体生物等效性研究技术指南 [EB/OL]。北京:国家药品监督管理局。
[8] 周 C, 吴玉玲, 陈 G, et al.: a, -,-,, III of -line/plus or in with or non-cell肺[J]. J Clin .2015, 33( 19):2197-2204.
[9] 石 Y、AU JS、S 等。A、EGFR在非细胞肺中的()[J].J. 2014, 9(2):154-162.
[10] 中华人民共和国国家卫生健康委员会。原发性肺癌诊疗规范(2018版)[EB/OL]. 北京:国家卫生健康委员会。
[11] RECK M、VON J、P 等。with-and or as-line for non-non-non-cell lung: from a III () [J]. 安 .2010, 21, 1804–1809.
[12] 何克,陈赫,T,等。在一个在一个 [J]. 临床研究。2016, 22(21):5167-5170.
[13] MA、MJ、A 等。Ⅲaby-line in-ⅢB/Ⅳ非细胞肺[J].J临床。2002, 20(5):1335-1343.
[14] PARK JO、KIM SW、AHN JS 等。非细胞肺中的二四之三 [J].J. 2007, 25(33):5233 -5239.
[15] NIHO S、H、H 等。II. 与非非细胞肺相伴或与非细胞相伴[J]. 肺。2012, 76(3):362-367.
[16] A、GRAY R、MC 等。– 或用于非细胞肺 [J]. N Engl J Med。2006, 355:2542–2550.
[17] M、T、H 等。,open-,II of in with and in-with or non-肺():[J]. J临床。2009; 27(15 秒)。
[18] DH、L、WF 等。II 加和带和在或非细胞肺[J]. J临床。2004, 22:2184–2191.
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话