欢迎光临吉康旅!
是目前在晚期患者中研究最充分的抗 PD-1 单克隆抗体。在晚期患者中完成了5项大规模III期研究,均取得了积极成果。基于这些发现,派姆单抗作为单药或与化疗联合使用已被批准用于晚期一线或二线治疗。最近,-021研究I期部分的三个队列的结果发表在《肺》杂志上,评估了派姆单抗联合不同化疗方案的疗效和安全性。本研究结果为后续III期联合研究(包括-189和-407).
背景
此前,EGFR 和 ALK 野生型晚期患者的标准一线治疗是含或不含维持治疗的铂类双药化疗。在非鳞状细胞癌患者中,部分患者可选择化疗联合贝伐单抗以提高疗效,但也会增加毒性。近年来,抗PD-1/L1单克隆抗体在晚期阶段大放异彩,显示出非常好的疗效。(抗PD-1单克隆抗体)作为PD-L1阳性晚期一线或二线治疗的单药,已显示出优异的疗效。在-024研究中,帕博利珠单抗q3w用于一线治疗EGFR/ALK野生型、PD-L1 TPS>=50%的晚期患者,与研究者选择的含铂双药化疗相比,可显着延长患者的治疗时间。PFS 和操作系统。在 II-III-010 期研究人员中,派姆单抗 2 或 10 mg/kg,q3w 治疗,与多西他赛 75mg/m2,q3w 治疗相比,可显着延长晚期治疗的 PD-L1>=1% 患者的 OS 和 HR分别为 0.71 和 0.61。
最近的一些研究结果表明,除了细胞毒性(杀死肿瘤细胞)外,含铂双药化疗还可以通过刺激肿瘤新抗原的释放来介导免疫作用,包括降低免疫抑制细胞的活性和数量,增加免疫抑制细胞的数量。的免疫抑制细胞。抗原呈递增强了 T 细胞攻击肿瘤细胞的活性。这些研究证据表明anti-PD-1联合化疗具有协同抗肿瘤作用。
-021 研究是一项多队列 I-II 期研究,评估 联合化疗对晚期疾病患者的疗效和安全性。该研究报告了 3 个参加 -021 研究 IB 期的队列,评估 2 mg 或 10 mg/kg 与紫杉醇卡铂联合用于任何组织学的患者和紫杉醇用于非鳞状细胞的患者。在非鳞状细胞癌患者中评估了派姆单抗 2 mg 或 10 mg/kg 联合紫杉醇\卡铂\贝伐单抗或派姆单抗 2 mg 或 10 mg/kg 联合培美曲塞\卡铂的疗效和安全性。主要研究目标是找到 II 期研究的推荐剂量。在 II-021 期研究队列 G 中,派姆单抗在非鳞状患者中进行了评估,
方法
该研究招募了没有 EGFR 突变或 ALK 重排、年龄 >=18 岁、组织学或细胞学证实为 IIIB/IV 期(队列 A 是任何组织学类型,队列 B 和 C 是非鳞状细胞)、未接受过全身治疗前晚期,至少有1个符合标准的可测量病灶,ECOG PS评分0-1,预期生存>=3个月,器官功能良好。排除标准:入组前6个月内接受过>30Gy的肺部放疗,有活动性中枢神经系统转移,2年内合并自身免疫性疾病需要全身治疗,合并活动性间质性肺炎需要全身治疗,口服或静脉注射激素治疗。
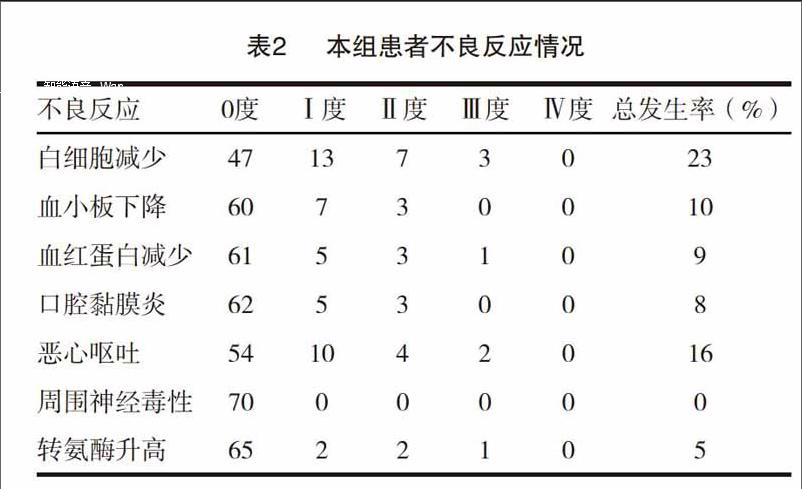
研究人员将入组患者随机分配到 3 种化疗方案中的任何一种,然后以 1:1 的比例随机分配接受派姆单抗 2 mg 或 10 mg/kg。3 个队列的化疗方案是: 队列 A(任何组织学)接受卡铂加紫杉醇;队列 B(非鳞状细胞)接受卡铂加紫杉醇和贝伐单抗;队列 C(非鳞状细胞) 接受卡铂联合培美曲塞。每3周为一个治疗周期,连续4个周期后,2年的帕博利珠单抗维持治疗或联合贝伐单抗维持治疗(队列B,可选)或联合培美曲塞,分别维持(队列C,可选),治疗至疾病进展或不可接受毒性或患者退出组。主要研究终点是确定 II 期研究的推荐剂量。在每个队列中,24 名患者被随机分配到派姆单抗的 2 个剂量组,每组 12 人。如果派姆单抗 10 mg/kg 剂量组中有 12 名患者,则只有 = 2 名患者出现 AE,包括:A 组(所有 n =2);B 组)中的结肠炎、甲状腺功能减退和输液反应,用于甲状腺功能减退(n =5) 和输液反应 (n=3))。针对甲状腺功能减退症 (n=4) 和肠炎 (n=3)) 的队列 C。3 主要免疫介导的 AE 和输液反应包括严重的皮肤反应(队列 A;n=1)、肠炎、肺炎和胰腺炎(队列 B;n=1);肠炎和严重的皮肤反应)。(队列 C;n=< @1). 未观察到 4 级或 5 级免疫相关 AE 和输液反应。在每个队列中,24 名患者被随机分配到派姆单抗的 2 个剂量组,每组 12 人。如果派姆单抗 10 mg/kg 剂量组中有 12 名患者,则只有 = 2 名患者出现 AE,包括:A 组(所有 n =2);B 组)中的结肠炎、甲状腺功能减退和输液反应,用于甲状腺功能减退(n =5) 和输液反应 (n=3))。针对甲状腺功能减退症 (n=4) 和肠炎 (n=3)) 的队列 C。3 主要免疫介导的 AE 和输液反应包括严重的皮肤反应(队列 A;n=1)、肠炎、肺炎和胰腺炎(队列 B;n=1);肠炎和严重的皮肤反应)。(队列 C;n=< @1). 未观察到 4 级或 5 级免疫相关 AE 和输液反应。在每个队列中,24 名患者被随机分配到派姆单抗的 2 个剂量组,每组 12 人。如果派姆单抗 10 mg/kg 剂量组中有 12 名患者,则只有 = 2 名患者出现 AE,包括:A 组(所有 n =2);B 组)中的结肠炎、甲状腺功能减退和输液反应,用于甲状腺功能减退(n =5) 和输液反应 (n=3))。针对甲状腺功能减退症 (n=4) 和肠炎 (n=3)) 的队列 C。3 主要免疫介导的 AE 和输液反应包括严重的皮肤反应(队列 A;n=1)、肠炎、肺炎和胰腺炎(队列 B;n=1);肠炎和严重的皮肤反应)。(队列 C;n=< @1). 未观察到 4 级或 5 级免疫相关 AE 和输液反应。
表2. AE 汇总
抗肿瘤活性
队列 A、B 和 C 中的患者的 ORR 分别为 48% (12/25)、56% (14/25)) 和 75% (18/24)),见表 3. 每个队列中 1 名患者获得完全缓解 (CR),其余患者获得部分缓解 (PR)。71 名患者的反应可评估,其中 65 名患者的目标疾病较基线有所降低。在所有 3 个队列中,不同的 PD-L1 TPS 组(>=50%、1-49% 和
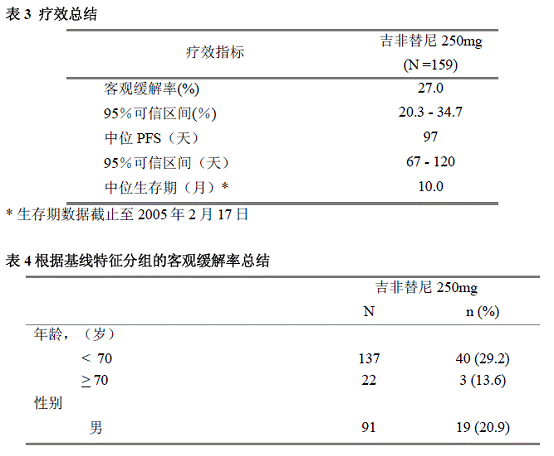
表 3. 独立评估委员会评估的 ORR(1.1 标准评估)
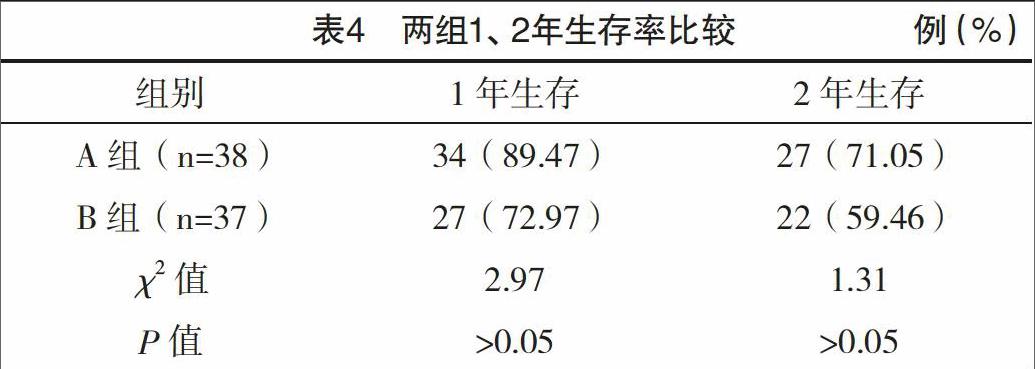
图 2. A 和 B:队列 A 患者的 PFS 和 OS;C 和 D:队列 B 患者的 PFS 和 OS;E 和 F:C 组患者的 PFS 和 OS
结论与讨论
在这项 I 期研究中,派姆单抗联合紫杉醇卡铂或培美曲塞卡铂在初治晚期疾病患者中显示出可耐受的毒性和有希望的抗肿瘤疗效。在 3 个治疗组中的任何一个和派姆单抗的两个剂量组中均未观察到 DLT。根据 治疗晚期头颈部鳞状细胞癌的 I 期研究结果, 是一种 q3w 固定剂量方案,具有良好的耐受性,并显示出与基于体重的给药方案相似的疗效。观察到 DLT,并推荐 ,q3w,作为 II 期和后续研究的给药方案。 的药代动力学,q3w,与 2 mg/kg,q3w 的药代动力学相似。
在这项研究中,与其他联合方案相比,派姆单抗与卡铂-紫杉醇和贝伐单抗联合使用增加了特定 AE 的发生率。因此,在随后的帕博利珠单抗联合化疗的III期临床试验中,并未采用贝伐单抗联合方案。从非鳞癌研究结果来看,四药联合方案并没有带来更大的生存获益,但副作用比-189\407更大。这表明了这项临床试验-021的重要性。本研究中队列 A 和 C 的结果强烈表明,派姆单抗联合铂类化疗是未经治疗的晚期疾病患者一线治疗的可行治疗策略。这一组合和安全性数据分别得到后续随机 III 期 -189 和 -407 研究的证实,目前已获 FDA 批准用于晚期非鳞状细胞癌(派姆单抗联合培美曲塞铂)或肺鳞状细胞癌的一线治疗(派姆单抗联合卡铂-紫杉醇或白蛋白结合型紫杉醇)。对中国患者来说,好消息是,这两种联合化疗的适应症也已被中国国家药监部门受理,有望在数月内获批使用。目前已获得 FDA 批准用于晚期非鳞状细胞癌(派姆单抗联合培美曲塞铂)或肺鳞状细胞癌的一线治疗(派姆单抗联合卡铂-紫杉醇或白蛋白结合型紫杉醇)。对中国患者来说,好消息是,这两种联合化疗的适应症也已被中国国家药监部门受理,有望在数月内获批使用。目前已获得 FDA 批准用于晚期非鳞状细胞癌(派姆单抗联合培美曲塞铂)或肺鳞状细胞癌的一线治疗(派姆单抗联合卡铂-紫杉醇或白蛋白结合型紫杉醇)。对中国患者来说,好消息是,这两种联合化疗的适应症也已被中国国家药监部门受理,有望在数月内获批使用。
参考
和 - 作为 - 行
对于非细胞肺:1 来自
-021 . 肺 125 (2018) 273–281.
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话