欢迎光临吉康旅!
肺癌是目前世界上发病率和死亡率最高的恶性肿瘤[1],其治疗一直是临床难题。越来越多的分子靶向药物的问世为肺癌的治疗提供了新思路,其中奥希替尼是具有代表性的表皮生长因子受体(EGFR)受体酪氨酸激酶抑制剂(TKI)。奥希替尼作为第三代TKI药物,可选择性抑制EGFR敏感突变和EGFR耐药突变,而对野生型EGFR活性较低[2]。编码EGFR激酶结构域的基因位于外显子18-24,非小细胞肺癌()患者的EGFR突变主要发生在外显子18-21[3],分为敏感突变和罕见突变. EGFR-TKI 对常见 EGFR 突变的疗效已得到认可,但对罕见 EGFR 突变的疗效研究较少。本文介绍了第三代TKI奥希替尼,并介绍了其在EGFR敏感突变和罕见突变方面的研究进展。
01、EGFR敏感和罕见突变
1.1 个敏感突变和
EGFR 敏感突变和点突变最为常见,占所有 EGFR 突变的 80% 至 90% [4,5]。指表达蛋白中746-752位氨基酸残基的框内缺失,突变为单核苷酸取代,在密码子858处用精氨酸取代亮氨酸[6]。在肺癌的发生发展过程中,突变和突变可使EGFR激酶活化成为主导状态,影响其下游的前细胞存活和凋亡活性[7]。虽然两者都是EGFR敏感突变,但由于突变区域不同,它们的分子结构也不同。突变区域决定了它的酶活性和对 TKI 的敏感性。突变位点位于C-lobe的激活环(A-loop)中,远离ATP结合位点,而突变发生在 ATP 结合位点 [2]。这种突变使酶比 . 它与 TKI 药物结合更紧密,与 TKI 药物结合松散[8]。TKI主要抑制细胞下游ERK1/2通路和AKT通路[9],使细胞主要停留在G1期,而细胞主要停留在G2期,说明TKI对细胞的抑制程度为穷人[10];通过上调-通路,可提高细胞侵袭能力,促进恶性胸腔积液的形成,影响预后[11]。并存突变的患者比例较高,疗效也较差[12];对于具有敏感突变的患者,其肿瘤突变负荷(TMB)与预后密切相关,高TMB人群预后较差。患者的TMB明显高于患者,提示患者预后较差[13]。
因此,TKI和突变亚群具有特定的作用机制,在分子结构、对TKI的反应、耐药机制、联合突变、TMB值等方面存在显着差异,是疗效差异的原因。
1.2 罕见的 EGFR 点突变,,
罕见突变是指EGFR基因激酶结构域中18-21外显子的一组不同突变,占所有EGFR突变的10%-20%[14]。除外显子 20 插入突变外,密码子 G719、L861 和 S768 的罕见突变最为常见[15]。点突变占 EGFR 突变肿瘤的 2% 至 5%。该突变导致 EGFR 外显子 18 中的甘氨酸( 719 )被丙氨酸( )或半胱氨酸( )和丝氨酸( )取代。突变可以单独发生,也可以与其他罕见突变(例如 或 )发生复合突变。点突变占1.5%~3%,点突变约占2%~3%[16]。
1.3 个外显子 20 插入突变
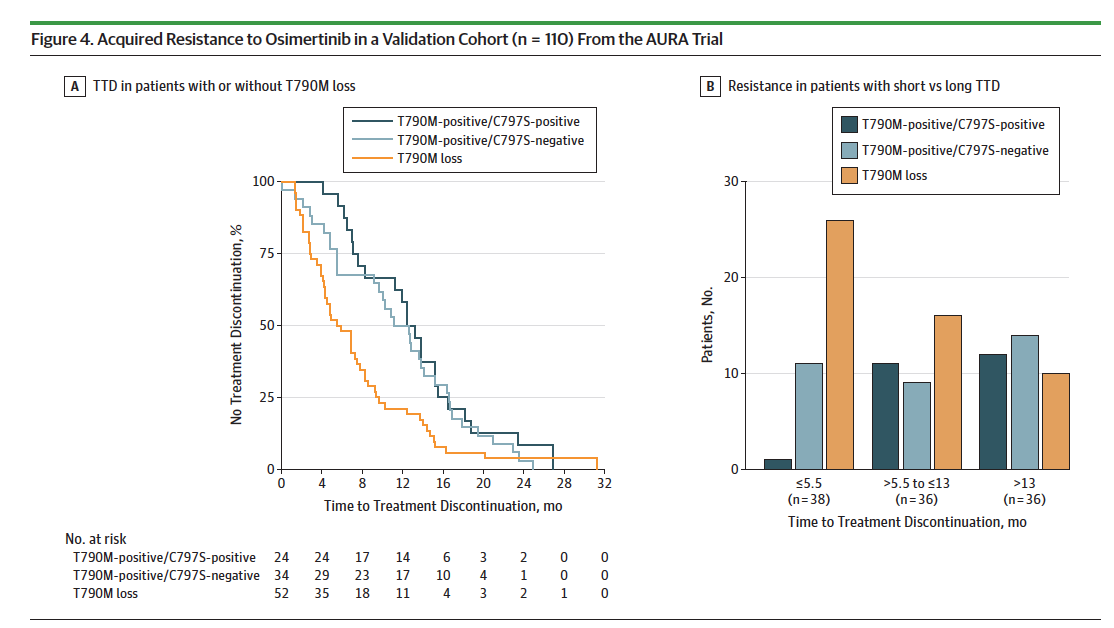
其中,5%-10%的EGFR突变位于EGFR外显子20,其中外显子20(exon)最为常见,占EGFR突变的4%-10%[17]。位置不同。外显子 20 后端的插入(A767-C775) 与 EGFR-TKI 抗性相关,前端插入(E762-Y764) 对 EGFR-TKI 敏感 [18])也解释了美国国家综合癌症网络(NCCN)指南没有将外显子20确定为完全耐药的原因,外显子20一直是临床上难突变的类型,而一、二代EGFR-TKI疗效有限,患者的生存获益远小于其他 EGFR 突变类型 [19]。
1.正面和负面
数据显示,外显子20上的点突变是一、第二代EGFR-TKI最常见的耐药机制,这种突变在约60%的患者疾病进展(PD)时可检测到[ 20]。利用组织测试作为广泛认可的黄金标准。血浆检测的灵敏度为组织检测的 51%,假阴性率高[21]。研究表明,血浆检测和组织检测阳性的患者在接受奥希替尼治疗后疗效相近,血浆检测阴性的患者建议再次检测以避免假阴性。
02、奥希替尼治疗EGFR突变
2.1敏感突变伴脑转移的一线治疗
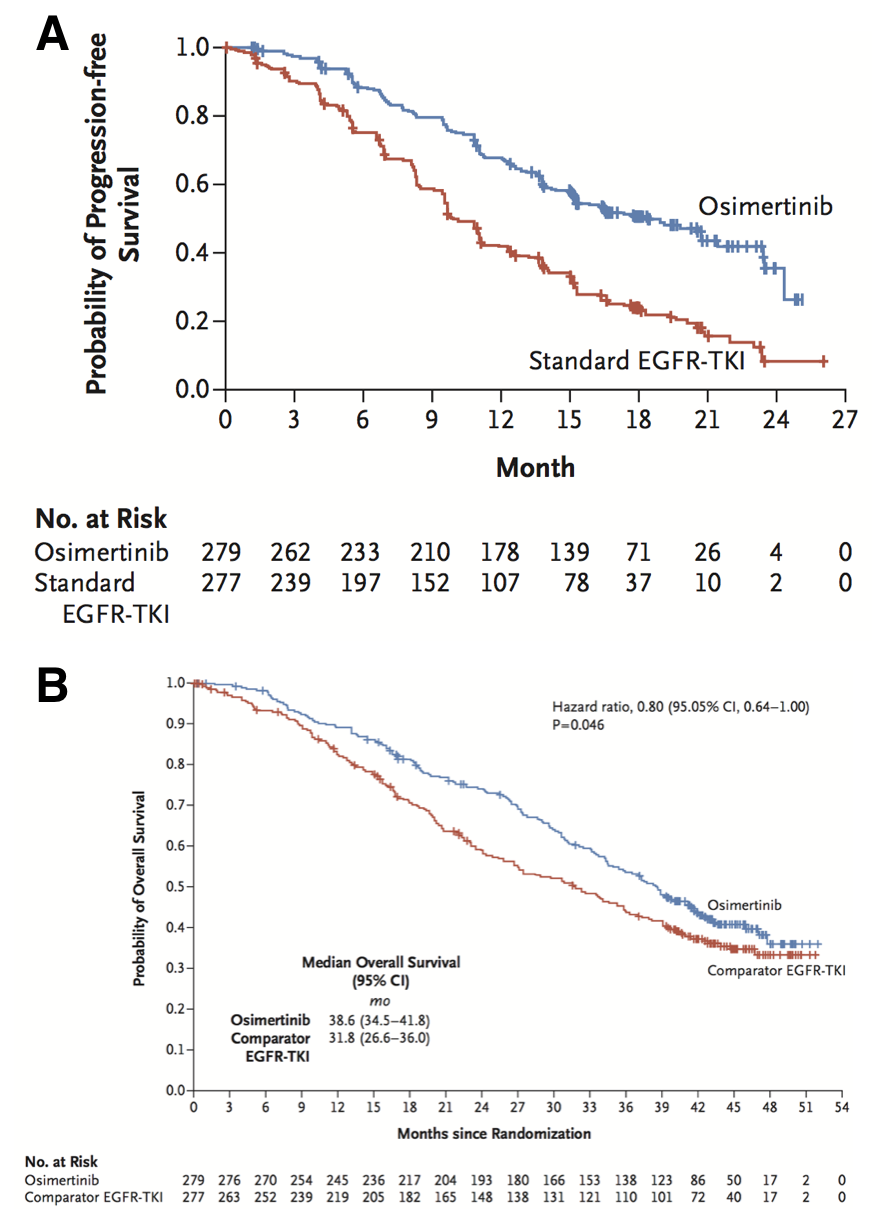
奥希替尼通过与 EGFR 激酶结构域的 ATP 结合结构域的半胱氨酸 797 残基不可逆共价结合来抑制其下游信号通路,从而抑制肿瘤增殖 [6]。临床数据证明,EGFR-TKI单药治疗对突变和突变有不同的作用。根据研究结果,人群中一线使用奥希替尼的中位无进展生存期(PFS)时间可达21.4个月,人群中的中位PFS时间仅为14.4 个月,总生存期(OS)没有显着的获益趋势。从安全性的角度来看,奥希替尼的不良事件少于第二代 EGFR-TKI [22,23]。目前,奥希替尼已被国内外批准作为EGFR突变阳性晚期的一线治疗药物。因此,对于患者,尤其是脑转移患者,奥希替尼可能是首选的治疗选择 [24]。
2.2 罕见突变治疗新突破
,并且是 3 种最常见的罕见突变类型。目前大多数EGFR-TKI相关的临床试验很少包括EGFR-rare患者,而第二代EGFR-TKI阿法替尼治疗罕见突变的研究相对较多。Yang等[25]在LUX-、3、6系列试验中发现,阿法替尼单独或联合治疗外显子18突变、外显子21突变或外显子20突变的患者突变,总反应率 (ORR) 分别为 77.8%、56% 和 100%。PFS 周期分别为 13.8、8.2 和 14.7 个月。这些数据为阿法替尼治疗罕见突变提供了一些证据。
弗洛克等人。[15] 对传统细胞系以及患者来源的细胞系进行了药效学实验,观察到奥希替尼可以影响 EGFR 细胞中的 EGFR 磷酸化;和其他突变。结果显示,奥希替尼在给药后2 h几乎被完全抑制,同时其磷酸化下游产物(如pAkt、pERK和pS6)的表达也受到抑制,两者均呈浓度依赖性。利用EGFR/rare双突变肺癌患者的肿瘤组织建立小鼠皮下PDX模型,造模成功后,小鼠每天口服25mg/kg奥希替尼药物(此浓度与临床相当至批准的 80 毫克剂量),而另一组小鼠每天口服7.5 mg/kg阿法替尼作为单药(这个浓度在临床上相当于批准的80 mg剂量和批准的40 mg剂量),肿瘤的变化连续给药14天后观察长度和直径。结果显示,奥希替尼组小鼠的肿瘤生长被完全抑制,肿瘤体积缩小,即抑制率超过100%;阿法替尼组小鼠的肿瘤抑制率为58%。同时,两组小鼠体重均无明显下降,说明在此浓度下,两种药物均未表现出毒性。PDX模型的体内实验数据表明,
KCSG-LU15-09 研究发现,奥希替尼在罕见的 EGFR 突变患者中表现出良好的活性和可控的毒性。纳入研究的 36 名患者中,19 例发生突变,9 例发生突变,8 例发生突变,1 例发生突变,1 例发生突变,1 例外显子缺失,1 例外显子 20 发生外显子突变。22例患者接受奥希替尼作为一线治疗,11例患者接受奥希替尼作为二线治疗,3例患者接受三线治疗(所有患者均无TKI用药史)。结果显示,ORR为50%,疾病控制率(DCR)为89%,缓解持续时间(DOR)为11.2个月(1例患者的DOR为31个月),28患者有肿瘤。缩小。36 例患者的中位 PFS 时间为 8.2 个月,1 年 OS 率为 86%,18 个月的 OS 率为 56%。亚组分析显示,突变患者的ORR为78%,中位PFS时间为15.2个月。突变患者的 ORR 为 53%,中位 PFS 时间为 8.2 个月。突变患者的ORR为38%,中位PFS时间为12.3个月。入组时9例患者发生脑转移,4例患者因接受放射治疗而被排除在疗效评价之外;其余 5 名患者中,2 名颅内缓解,ORR 为 40%。在奥希替尼治疗 6 个月后,其中一名突变患者因颅内多处病变而完全消失。不同级别的不良事件是可控的[26]。中位 PFS 时间为 15.2 个月。突变患者的 ORR 为 53%,中位 PFS 时间为 8.2 个月。突变患者的ORR为38%,中位PFS时间为12.3个月。入组时9例患者发生脑转移,4例患者因接受放射治疗而被排除在疗效评价之外;其余 5 名患者中,2 名颅内缓解,ORR 为 40%。在奥希替尼治疗 6 个月后,其中一名突变患者因颅内多处病变而完全消失。不同级别的不良事件是可控的[26]。中位 PFS 时间为 15.2 个月。突变患者的 ORR 为 53%,中位 PFS 时间为 8.2 个月。突变患者的ORR为38%,中位PFS时间为12.3个月。入组时9例患者发生脑转移,4例患者因接受放射治疗而被排除在疗效评价之外;其余 5 名患者中,2 名颅内缓解,ORR 为 40%。在奥希替尼治疗 6 个月后,其中一名突变患者因颅内多处病变而完全消失。不同级别的不良事件是可控的[26]。入组时9例患者发生脑转移,4例患者因接受放射治疗而被排除在疗效评价之外;其余 5 名患者中,2 名颅内缓解,ORR 为 40%。在奥希替尼治疗 6 个月后,其中一名突变患者因颅内多处病变而完全消失。不同级别的不良事件是可控的[26]。入组时9例患者发生脑转移,4例患者因接受放射治疗而被排除在疗效评价之外;其余 5 名患者中,2 名颅内缓解,ORR 为 40%。在奥希替尼治疗 6 个月后,其中一名突变患者因颅内多处病变而完全消失。不同级别的不良事件是可控的[26]。
该研究证实了奥希替尼在罕见患者中的疗效。尽管数据量较小,但 ORR 和 PFS 时间的结果令人鼓舞,并为罕见突变人群提供了另一种治疗选择。
2.3 罕见的外显子 20 突变需要更多探索
体外和临床前动物研究表明,奥希替尼对 EGFR 外显子 20 突变具有抗肿瘤活性 [27]。目前美国食品药品监督管理局 (FDA) 批准的 一、 第二代 EGFR-TKI(吉非替尼、厄洛替尼、阿法替尼等)对 EGFR 外显子 20 突变低的 ORR 较好,约为 8% [28]。一项对三项LUX-Lung 2、3、6临床试验的分析显示,在600名接受阿法替尼一线治疗的患者中,75名患者出现EGFR罕见突变,其中23名为第20外显子突变。23例外显子20突变患者在阿法替尼一线治疗后ORR为8.7%,中位PFS时间为2.7个月,中位OS时间为9.2月,表明阿法替尼对外显子 20 突变的疗效有限 [25]。
[17]显示,奥希替尼对EGFR外显子20突变晚期患者的抗肿瘤活性有限,ORR仅为5%。2016-2018年荷兰4家医疗机构入组21例晚期外显子20突变患者(13例患者既往接受过铂类化疗,3例接受过第一代或第二代EGFR-TKI治疗),80 mg或每天一次接受 160 mg 奥希替尼。结果显示部分缓解(PR)1例,疾病稳定(SD)17例,PD3例,ORR仅为5%;中位 PFS 时间为 3.6 个月;并发 TP53 突变患者的 PFS 差异无统计学意义(P=0.937);3 个月时 DCR 为 71%;中位 OS 时间为 8.7 个月。
此外,杨等人。[30]报道,在我国26个不同地区的99家医院就诊的165名晚期EGFR外显子20突变患者的样本中发现了39种不同的插入类型,其中最常见的占23%。基线时 23% 的患者存在脑转移。研究还发现,接受一线化疗的患者PFS时间为6.4个月,而一线EGFR-TKI治疗的PFS时间仅为2.9个月,差异为统计学显着(P
然而,韩国癌症研究小组(LU17-19) 多中心 II 期临床试验 [31])旨在评估标准化疗失败后的奥希替尼(作为二线和后线治疗)。外显子突变患者的疗效。本研究入组15例EGFR外显子20突变患者接受奥希替尼治疗,其中3例接受二线治疗,12例接受三线及以上治疗,其中7例患者达到SD,3例EGFR外显子20突变M76< @6、A767 和未知基因座在数据截止时仍在接受奥希替尼(SD 时间 12、7、7 个月)。15例患者的中位PFS时间3.5个月(95% CI 1.6个月~未达到),中位OS未达到(1年OS率为56.3%), 6 个月时的 DCR 为 31.1%。[31] 本研究纳入的患者在晚期接受了奥希替尼治疗,80%的患者接受了三线及以上治疗。目前研究仍在进行中,值得关注其后续OS结果。Fang等[32]显示奥希替尼联合西妥昔单抗对20号EGFR外显子突变的患者有效。在该研究中,患者接受了 6 个周期的初始标准化疗(培美曲塞 + 卡铂 + 贝伐单抗),随后是培美曲塞 + 贝伐单抗维持治疗。如有进展改用奥希替尼联合西妥昔单抗治疗,原发肺肿瘤及转移灶缩小达到PR,患者PFS时间>5个月,
2.突变阴性耐药的新尝试
III 期临床研究包括 EGFR-TKI 治疗后发生突变的未接受化疗的患者。共有 419 名患者被随机分配到奥希替尼组或化疗组(培美曲塞 + 铂),分配比为 2:1,随后接受或不接受培美曲塞维持治疗。结果显示,奥希替尼组疗效显着优于化疗组,ORR分别为71%和31%,中位PFS时间分别为10.1个月和4.@分别 > 4 个月 (HR)。=0.32; 95%CI 0.21~0.49)。奥希替尼治疗显着延长了培美曲塞 + 铂组的 PFS 时间。在大多数患者接受第一代 EGFR-TKI 后,大脑是 PD 的常见部位 [33]。数据显示,奥希替尼在脑膜转移的非人类灵长类动物模型中显着可视化脑损伤,显示出其对血脑屏障的强烈渗透[34]。在亚组分析中,据报道,与化疗相比,奥希替尼具有更高的 CNS 反应率(70% vs. 31%)和更长的 CNS PFS(11.7 个月 vs 5.6 个月)。
对于继发性阴性的患者,研究表明奥希替尼疗效有限,因此上一代TKI耐药患者大多只能转为化疗。TREM研究证实了奥希替尼对阳性患者的疗效,在一些阴性患者中,奥希替尼也具有显着的临床活性。该研究包括在 EGFR-TKI 上取得进展(至少一次,无论阳性)的患者,每天服用 80 mg 奥希替尼,主要终点是 ORR。共纳入 199 名患者,120 名(60%)突变阳性,52 名(26%)阴性,27 名(14%)患者突变状态未知。所有患者的 ORR、PFS 和 OS 时间分别为 48%、8.9 个月和 17.9 个月,
03、总结
综上所述,奥希替尼不仅可用于EGFR敏感突变患者的一线治疗,还能显着延长患者的PFS期,对EGFR的罕见突变也有一定的疗效。在EGFR-TKI中,奥希替尼是第一个在一线治疗中取得阳性OS结果的药物。未来还需要更多的临床研究来证实其有效性,让更多的晚期EGFR突变患者获得更大的生存获益。
免责声明:所有作者声明没有利益冲突
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话