欢迎光临吉康旅!
陈敏山
教授,主任医师,博士生导师。现任中山大学肿瘤中心肝外科主任、中山大学肝癌研究所所长。兼任中国抗癌协会肝癌专业委员会主任委员、中国医师协会肝癌专业委员会副主任委员、广东省医学会肝癌分会主任委员、荣誉委员。广东省抗癌协会肝癌专业委员会主任委员,香港中文大学外科学客座教授。.
从事肝癌临床及研究工作30年,主要研究方向为外科。熟悉并掌握多种肝癌治疗方法,积极推进肝癌多学科综合治疗。共发表肝癌研究论文162篇,连续6年入选中国高被引学者名单;共有6篇临床研究论文被美国NCCN指南“肝癌”部分引用。主持的“肝癌多学科治疗策略、优化与应用”研究获得2016年广东省科学技术奖一等奖。2014年被评为首届“中山大学名医”,
2020年肝癌治疗进展年度盘点
胡丹丹、陈敏山
中山大学肿瘤中心肝外科
【摘要】乙肝疫苗在我国全面实施近30年。乙肝病毒感染率有所下降,但肝癌的发病率和死亡率居高不下。目前,肝癌的治疗模式已从单一的局部治疗转变为包括手术、消融、介入、靶向、免疫治疗在内的多学科综合治疗。与局部治疗相比,2020年肝癌药物治疗领域取得了显着进展。本文将从局部治疗和全身治疗两个方面系统总结今年肝癌的研究进展。
【关键词】肝细胞癌;多学科综合治疗;靶向治疗;免疫疗法
乙肝疫苗全面实施近30年后,我国仍是肝癌高发国家。近年来,肝癌的治疗已从单一的局部治疗转变为多学科综合治疗,即局部治疗与全身治疗相结合的模式,为患者带来了显着的肿瘤学益处。2020年,全球遭遇罕见的新冠肺炎疫情。在从事新冠肺炎研究的同时,医学相关从业者在自己既定的研究领域仍然取得了不错的成绩。在肝癌的治疗方面也有许多重要的研究进展。本文对这不平凡的一年肝癌临床治疗研究领域进行了概述。
一、局部治疗
1.1 手术切除/消融/放射治疗
手术切除是目前肝癌最常用的根治方法,通过多学科模式进一步提高肝切除和局部消融治疗的效果一直是临床研究的重点。
今年的主要国际会议公布了新辅助和转化治疗的多项研究进展。其中,2020年美国临床肿瘤学会(ASCO)年会发布了新辅助治疗的研究海报。30例肝癌患者术前接受了3个周期的纳武利尤单抗联合易普利姆玛或纳武利尤单抗单药治疗肝细胞癌(HCC)。24%(联合组3例,单药组2例),主要病理缓解率为16%(坏死效应,联合组2例,单药组1例),并且没有导致手术推迟或取消的毒性[1]。
更值得注意的是关于转化治疗的几项研究:一项针对 60 名不可切除 HCC 患者的研究在 ASCO 年会上发表(2 名患者为 BCLC-A 期,13 名患者为 B 期,45 名患者为 C 期)。, 9 例 (18.3%) 转化为可切除的 HCC 并进行了手术切除,其中 6 例患者被证实为病理完全缓解[2]。该研究为晚期肝癌患者获得长期生存获益带来希望。
此外,ESMO ASIA会议上发布的另一项研究:35例不可切除的HCC患者接受TKI联合PD-1抑制剂治疗,其中门静脉癌栓30例,肝静脉癌栓2例,肝静脉癌栓3例。肝静脉瘤栓。两个都; 共有 33 名患者可评估。研究结果显示,基于放射学的成功转化率为42.4%(14/33)。随后进行R0手术切除,未观察到严重并发症或术后死亡。中位随访时间 7.2 个月,中位无复发生存期(free, RFS)时间和中位总生存期( , OS)时间分别为 3.9 个月和 6.@,分别 >5 个月[3]。
以上两项研究提示TKI与PD-1抑制剂联合治疗是晚期HCC转化治疗的安全有效选择。
长期以来,肝细胞癌后是否需要辅助治疗也一直是研究热点。今年6月,一项多中心研究探讨了碘[131I]美妥昔单抗作为根治性肝细胞癌后辅助治疗的作用。该研究包括 156 名表达 HCC 的患者。治疗组患者术后4~6周肝动脉注射碘[131I]美妥昔单抗1次。增加(43.4%:21.7%,P=0.0031),提示该辅助方案可改善患者预后[4],也建议肝癌患者应根据生物标志物进行细分,以进行更精准的方案制定和管理。
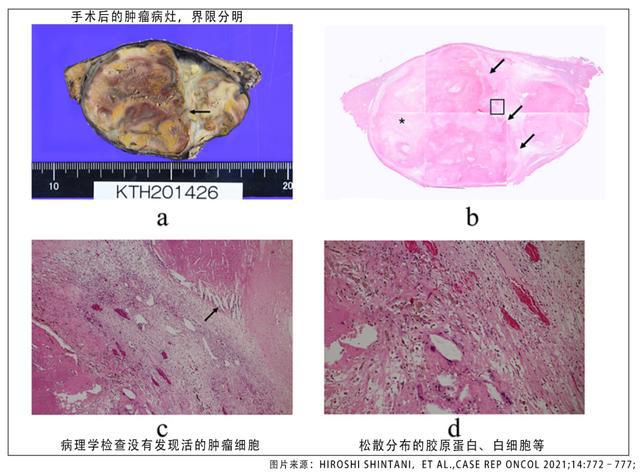
今年的 ASCO 年会还报告了一项多中心、前瞻性队列研究的中期分析结果,该研究将乐伐替尼联合肝动脉化疗栓塞 (TACE) 用于 HCC 术后复发高风险患者的辅助治疗 (研究)。共90例术后复发高危患者(大血管或胆管侵犯/肿瘤破裂或邻近器官浸润/Ⅱ级微血管侵犯合并以下任意一种:肿瘤数量≥3,最大肿瘤直径≥8 cm,肿瘤边缘不清晰或无完整包膜)。结果显示,乐伐替尼联合TACE组患者的中位无病生存时间(DFS)明显长于单独TACE组(12.0个月:8.0个月; 人力资源= < @0.5,P=0.0359)[5]。初步提示乐伐替尼联合TACE辅助治疗安全有效,可延长高复发风险HCC患者术后预后。无进展生存期。
另一项研究的中期结果也令人感兴趣,该研究也使用干预作为手术后的辅助治疗。该研究是一项前瞻性、开放标签、III期、随机对照试验。入组患者为 127 例 HCC 患者,术后病理发现有微血管侵犯。随机分为治疗组和随访组。治疗组患者术后接受2个疗程的肝动脉灌注化疗(HAIC)。结果显示,治疗组6、12、18个月患者OS率分别为100.0%、97.7%和97.@ >7%,分别;随访组患者分别为94.5%、89.6%和78.5%(P=0.037). 治疗组患者6、12、18个月的DFS率分别为84.7%、61.8%和58.7%,分别; 随访组患者分别为62.9%、48.1%和38.6%(P=0.023)[ 6]. 研究中期分析 结果表明,肝切除术后辅助HAIC治疗可以改善微血管侵犯HCC患者的OS时间和DFS时间。
放射治疗技术的进步使其在肝癌治疗中的作用突出,但其应用范围仍需进一步探索。今年,一项亚洲多中心研究比较了立体定向全身放射治疗(body,SBRT)和射频消融(RFA)的疗效,发现SBRT组和RFA组患者3年累积局部复发率为2 1.2%和27.9%(P[6]。此外,放疗在门静脉癌栓的治疗中也有一定的优势。有研究报道对于完全可切除的肝癌联合对于门静脉癌栓,手术新辅助放疗可以改善患者的预后[7]。在目前的临床实践中,对于不适合手术切除和射频消融的小肝癌患者,放疗仍是一种有效的治疗选择,也可以与其他治疗有机结合。采用。
1.2 介入治疗
TACE是不能手术的中晚期HCC最常用的治疗方法之一,但在改善患者预后方面仍不尽如人意。改进的 HAIC 显示出更好的治疗潜力。
2019年,中山大学肿瘤防治中心石明教授团队在JAMA上发表研究,比较HAIC和索拉非尼在晚期肝癌中的应用。显着延长患者生存时间(13.37个月:7.13个月,P<0.001)[8]。在今年的ESMO会议上,团队口头报告了一项随机、多中心 RCT 研究。
在这项试验中,315 名成人(≥18 岁)患有不可切除的 HCC,最大直径 ≥7 cm,无大血管侵犯或肝外转移的患者以 1:1 的比例随机接受 HAIC(n=159) 或 TACE (n=156)治疗。结果显示HAIC组患者的中位OS时间高于TACE组(23.1个月:16.@>07个月)。与 TACE 组相比,HAIC 组的客观缓解率(ORR)更高(:45.9%:17.9%,P[9]。在切除的 HCC 患者中,HAIC在肿瘤效率和转化切除方面显示出令人惊讶的功效。
同时,史明教授在ESMO年会上的另一项海报研究中,回顾性分析了乐伐替尼+特瑞普利单抗+HAIC与乐伐替尼单药治疗157例晚期肝癌患者的疗效和安全性。. 研究结果显示,三联治疗组患者的 PFS 时间更长(11.1 个月 vs 5.1 个月,P[10],表明 HAIC 联合乐伐替尼和特瑞巴普利单抗可显着提高晚期肝癌患者的疗效上述研究初步表明,HAIC对晚期肝癌具有前所未有的令人满意的疗效。
二、身体疗法
2.1 靶向治疗
近年来,靶向药物治疗肝癌取得了多项突破,索拉非尼不再是肝癌靶向治疗的唯一药物。
首先,瑞戈非尼确立了索拉非尼治疗进展后的二线治疗地位。随后,该研究证实了乐伐替尼在肝癌一线治疗中的地位,成为继索拉非尼之后的第二个肝癌治疗药物。有效的药物。
在今年 ASCO 年会上的口头报告中,有两项单独针对靶向药物的研究。阿帕替尼作为中国晚期肝癌患者二线治疗的随机、安慰剂对照、双盲 III 期研究。患者随机分为阿帕替尼组(n=261)和安慰剂组(n=132)),结果显示阿帕替尼组疗效明显优于安慰剂组(mOS: 8.7 个月:6.@>8 个月,HR=0.785,P=0.0476;PFS:4.5 个月:1.9个月,HR=0.471,P˂0.0001;ORR:10.7%:1.5%)[11]。结论是,阿帕替尼可以显着延长一线耐药晚期HCC患者的OS时间和PFS时间,
另一项是多纳非尼与索拉非尼在晚期 HCC 一线治疗中的开放标签、随机、多中心 II/III 期试验。共纳入 668 名患者,并按 1:1 随机分配。结果显示,多纳非尼组患者的OS时间比索拉非尼组长(mOS:12.0个月:10.1个月,HR=0.839, P=0.0446),但mPFS、ORR、DCR无显着差异,多纳非尼组≥3级不良反应发生率较低(57.4% : 67.5%, P=0.0082)[12].这是索拉非尼自13年前上市以来首次单药III期临床研究. 它的有效性。
2.2 免疫疗法
近年来,免疫检查点抑制剂(ICIs)在肿瘤治疗领域掀起了一场革命。单药治疗方面,在He-224研究确立了纳武利尤单抗和派姆单抗在肝癌二线治疗中的地位后,启动了III期临床研究和一线治疗研究。
纳武利尤单抗一线治疗晚期肝癌的结果显示,患者的OS时间达到16.@>4个月,虽然与索拉非尼相比(中位OS时间为14.7个月)没有有统计学意义,但其客观缓解率和完全缓解率均优于索拉非尼[13]。
的III期临床试验(-240)比较了单药治疗和安慰剂的治疗效果,虽然主要终点的差异没有达到预期[14],但单克隆抗体带来的生存获益是重大。
2020年,秦树奎教授牵头的国内多中心研究发表。研究中,217例一线治疗失败的HCC患者接受了二线治疗(109例患者每2周治疗一次,108例患者每3次治疗每周1次),中位随访时间为12.5 个月。结果:217 例患者中有 32 例报告了客观反应(14.7%);6 个月总生存率为 74.4%;22% 的患者经历了 3 级或 4 级治疗相关的不良事件;证实了卡瑞利珠单抗在晚期肝癌二线治疗中的疗效和安全性[15]。
2.3 联合治疗
与ICI单药治疗相比,联合治疗领域可谓是一大利好消息。2020年ASCO年会报道了联合治疗不可切除肝癌患者的Ib期研究(-524)更新数据:联合治疗组mOS时间为20.4个月, mPFS时间9.7个月,标准下客观缓解率高达44.8%[16],显示出两者结合的良好疗效和耐受性[17],该治疗方案也被美国FDA评为“突破性疗法”,基于此的III期临床试验(LEAP 002))正在进行中,结果值得期待。
本研究是阿特珠单抗联合贝伐单抗对比索拉非尼的 III 期随机对照研究。共有 501 名不可切除的 HCC 患者入组并随机接受阿特珠单抗联合贝伐单抗抗治疗或索拉非尼单药治疗。最终结果显示,联合治疗组患者的中位OS尚未达到,索拉非尼组患者的中位OS时间为13.2个月(P=0.000 6);此外,联合治疗组患者的PFS时间为6.@>8个月,索拉非尼组患者为4.3个月(P[19]. 该方案已获CSCO 批准《肝癌诊疗指南2020》作为一线治疗专家的一线推荐,也被纳入NCCN临床实践指南:肝胆肿瘤作为一线治疗方案。一线推荐。联合贝伐单抗打破了晚期肝癌的一线治疗。僵局已成为HCC的一线治疗,也有望成为肝癌的新标准治疗。靶向治疗联合免疫治疗显示出药物联合治疗的广阔前景,也预示着肝癌的全身治疗将进入精准化、联合化、多元化的道路。时代。肝胆肿瘤作为一线推荐。联合贝伐单抗打破了晚期肝癌的一线治疗。僵局已成为HCC的一线治疗,也有望成为肝癌的新标准治疗。靶向治疗联合免疫治疗显示出药物联合治疗的广阔前景,也预示着肝癌的全身治疗将进入精准化、联合化、多元化的道路。时代。肝胆肿瘤作为一线推荐。联合贝伐单抗打破了晚期肝癌的一线治疗。僵局已成为HCC的一线治疗,也有望成为肝癌的新标准治疗。靶向治疗联合免疫治疗显示出药物联合治疗的广阔前景,也预示着肝癌的全身治疗将进入精准化、联合化、多元化的道路。时代。靶向治疗联合免疫治疗显示出药物联合治疗的广阔前景,也预示着肝癌的全身治疗将进入精准化、联合化、多元化的道路。时代。靶向治疗联合免疫治疗显示出药物联合治疗的广阔前景,也预示着肝癌的全身治疗将进入精准化、联合化、多元化的道路。时代。
在今年的重大国际肿瘤学会议上,靶向药物联合ICI的研究成果被披露。ESMO年会相关海报6张,均为I/II期研究。使用的药物不同。有一线方案和二线方案,但安全性和有效性都不错。已报道的用药方案包括:阿帕替尼联合卡瑞利珠单抗、乐伐替尼联合、信迪利单抗联合安罗替尼等[20-22]。
ESMO ASIA会议进一步报告了-32研究的结果。本研究是一项随机、开放标签、多中心、II/III期研究,旨在评估信迪利单抗联合贝伐单抗一线治疗晚期HCC的疗效和安全性。对照组接受索拉非尼单药治疗。按照2:1的比例,380例患者随机接受(200 mg,每3周一次,静脉注射)+贝伐单抗(15 mg/kg,每3周一次,静脉注射)治疗,191例患者接受了索拉非尼(400毫克,2 次/天)。中位随访时间为 10.0 个月,与索拉非尼组相比, 和贝伐单抗组的中位 OS 时间显着延长(NE:1 0.4 个月),ORR 为20.3% (74/364, 95% CI: 16.@>3-24.8),
过去的一年,依然是肝癌治疗免疫治疗领域取得突破的一年。与免疫单药治疗相比,联合治疗显示出更精准、更显着的疗效。免疫联合方案不仅在晚期肝癌患者的药物治疗方面取得了突破性进展,而且在局部联合治疗和围手术期治疗(包括术前新辅助治疗、转化治疗和辅助治疗)方面也显示出广阔的前景。联合免疫方案不仅限于中晚期肝癌的全身治疗,还可以通过与局部治疗的有机结合,应用于早、中期肝癌的治疗,并贯穿于整个肝癌的治疗中。肝癌的治疗和管理。
随着药物疗效的不断提升,肝癌的多学科治疗模式有望迎来新格局。局部治疗与药物治疗的有机结合,将为肝癌患者提供更有效的治疗选择,充分体现多学科治疗的有效性。优势。近日,《中国肝癌多学科综合治疗专家共识》发布[24]。本共识是在《原发性肝癌诊疗规范(2019版)》的基础上对多学科问题的细化和补充[25]。
参考
[1] 好的,等。2020 年 ASCO[C]. 4599.
[2] 孙等人。ASCO 2020[C]。.
[3]W 等人。ESMO 亚洲 2020[C]。174P。
[4]李杰,等。131I-代表代表:a, , , open-, 2 [J]. , 2020, 5(6):548-560.
[5] 陈金红,等。ASCO 2020[C]。4580.
[6] 金 N、J、Jung I 等人。身体与内用 [J]. J, 2020, 73(1):121-129.
[7]魏新,等。- 对于有静脉:A,开放-,[J]。临床杂志, 2019. 37(24):2141-2151.
[8]何敏,李奇,邹睿,等。Plus of , , and vs for With Vein : A [J]. 美国医学会杂志, 2019, 5(7):953-960.
[9] 石敏,等。ESMO 2020[C]。981O。
[10] 赖志昌,等。ESMO 2020 [C]。172P。
[11] 邱丽. 2020 年 ASCO[C]. 4507.
[12]冯碧. 2020 年 ASCO[C]. 4506.@>
[13] 邱腾等人。: A , -III of (NIVO) vs (SOR) as -line (1L) in (pts) with (aHCC)[J]. 安, 2019.
[14]Finn RS、Ryoo BY、P 等人。As -Line in With in -240: A , -, III [J]. 临床杂志, 2020, 38(3):193-202.
[15]秦S,任Z,孟Z,等。中与:a , open-, -, , 2 [J]. , 2020, 21(4):571-580.
[16] X.朱,等。2020 年 ASCO[C]. 4519.
[17] J 等人。(uHCC)中的(LEN)加()的1b:[J]. Asia Pac J Clin , 2019, 15:189-190.
[18] Lee MS、Ryoo BY、Hsu CH 等。. with or in (): an open-, , 1b [J]. , 2020, 21(6):808-820.@ >
[19] 阿尔等人。: 并且从 ph III () + (bev) vs (Sor) as (tx) for (pts) with (HCC)[J]. 安, 2019, 30.
[20]徐建民,等。ESMO 2020[C]。983P。
[21]林申,等。ESMO 2020[C]。987P。
[22] 陈晓,等。ESMO 亚洲 2020 [C]。170P。
[23]任志刚,等。ESMO 亚洲 2020[C]。LBA2.
[24] 中国抗癌协会肝癌专业委员会。中国肝癌多学科综合治疗专家共识[J]. 中华医学前沿杂志(电子版), 2020, 12 (12): 28-36.
[25] 中华人民共和国国家卫生健康委员会医管局医政局。原发性肝癌诊疗指南(2019年版)[J]. 综合癌症治疗电子杂志,2020 年,第 6 期(2):55-85。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话