欢迎光临吉康旅!
ASCO会议期间,关于新药新研究的新数据层出不穷。与此同时,国内外也有振奋人心的消息,肝胆领域取得突破@>获得美国FDA授予的治疗胆管癌的孤儿药认定。6月3日,罗氏制药宣布,中国国家药品监督管理局(NMPA)批准抗血管生成靶向药物®(贝伐单抗)正式获批用于肝细胞癌适应症。
贝伐单抗获批肝癌,一线联合治疗新数据公布,适用人群进一步扩大
贝伐单抗在中国获批的具体适应症为:与(以下简称“T+A”联合疗法)联合用于治疗之前未接受过全身治疗的不可切除肝细胞的癌症(HCC)患者。贝伐单抗的批准主要基于III期临床试验的结果。最新随访数据显示,晚期肝癌“T+A”一线治疗的OS为21.1个月,中国亚组人群OS长达24个月。本次ASCO会议还介绍了最新的探索性分析数据。
由于门静脉压力升高导致的不良预后和血流动力学变化,门静脉癌栓患者通常被排除在关键的 HCC 试验之外。在这里,我们使用更新的数据报告了 Vp4(主要和/或对侧门静脉中存在肿瘤血栓)肝癌患者的探索性疗效和安全性分析。
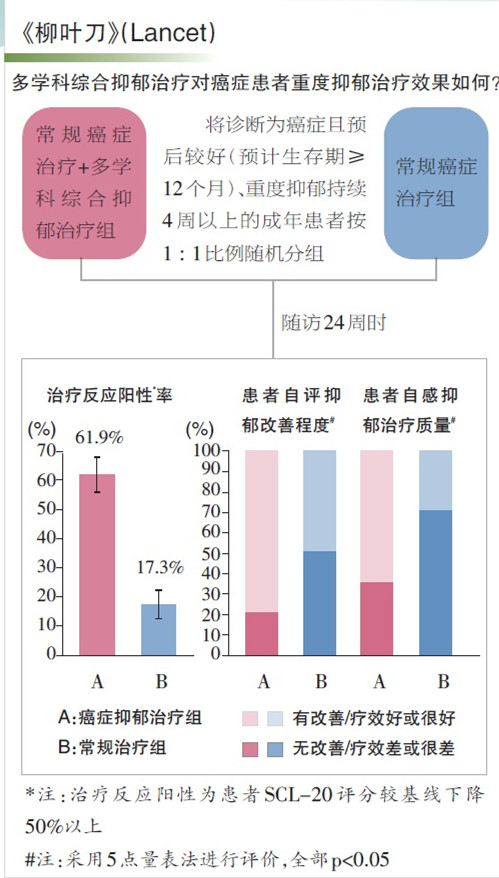
共有 73 名伴 Vp4 的 HCC 患者被纳入研究,48 名接受“T+A”治疗,25 名接受索拉非尼治疗。中位 OS (mOS) 分别为 7.6vs5.5 个月。中位无进展生存期 (mPFS) 分别为 5.4vs2.8 个月。
ORR分别为23%和13%,“T+A”组2例患者达到CR,索拉非尼组1例患者达到CR。
在安全性方面,在Vp4患者中,“T+A”组的全级静脉曲张出血发生率(13.6%)高于整体治疗人群(2. 5%)。
总之,在 Vp4 患者中,“T+A”与索拉非尼的治疗效果在所有疗效终点上与其他 ITT 人群一致。在所有疗效终点中,“T+A”在 Vp4 患者中优于索拉非尼,预计静脉曲张出血的疾病内在增加。总体收益-风险分析支持在 Vp4 患者中使用 加贝伐单抗。
ASCO发布新数据
ICP-192孤儿药称号当之无愧
是诺诚健华自主研发的新型高选择性泛FGFR(成纤维细胞生长因子受体)抑制剂。它可以通过共价结合不可逆地抑制FGFR的活性,也可以克服第一代可逆的FGFR抑制剂。获得性抵抗。目前,该产品处于1/2期临床阶段,在晚期实体瘤患者中评估该抑制剂的安全性、耐受性和药代动力学/药效学(PK/PD)特性。.1 评估 FGF/FGFR 基因突变患者初步疗效的标准。更新的数据也在 ASCO 会议上公布。
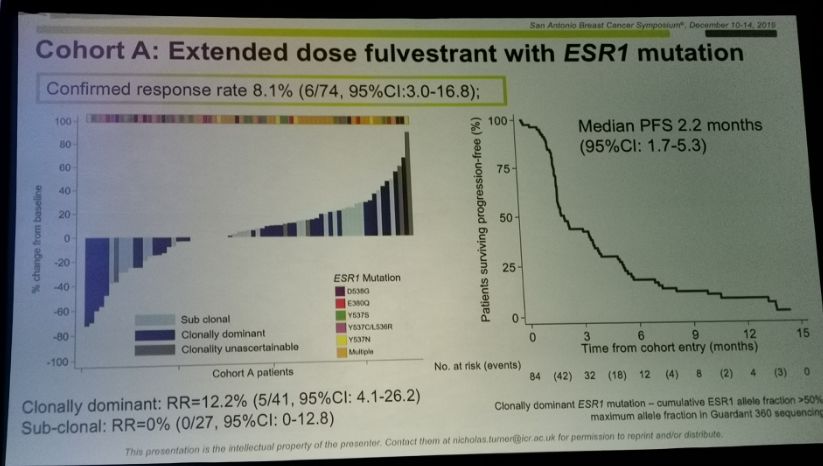
ICP-CL - 是一项首次在人体中进行的 I/lla 期剂量递增和剂量扩展研究,用于评估晚期实体瘤患者的安全性和有效性。总共治疗了30名患者。在剂量递增阶段,对于伴有或不伴有 FGF/FGFR 改变的晚期实体瘤患者,使用递增剂量(2、4、8、10、12、14、16 毫克等),每天一次,持续 21 天循环直到疾病进展或不可接受的毒性;具有基因融合/易位的胆管癌患者在剂量扩展阶段接受了每天 12 mg 的连续治疗。
未报告剂量限制性毒性(DLT),也未达到最大耐受剂量(MTD)。中心性浆液性视网膜病变(CSR)/视网膜色素上皮脱离(RPED)尚未见报道。最常见的治疗相关不良事件 (>20%) 包括高磷血症、高钙血症、ALT 或 AST 升高、腹泻和高甘油三酯血症。
在完成至少一项肿瘤评估的 12 例 FGF/FGFR 基因改变患者中,总缓解率(ORR)为 33.3%,其中 1 例(8.3%)胆管癌完全缓解(< @8.3%)。CR),3例(25%)胆管癌达到部分缓解(PR),疾病控制率(DCR)为91.7%。
它在晚期实体瘤患者中是安全且耐受性良好的。已在多种肿瘤类型中显示出抗肿瘤活性,包括具有改变的 FGF/FGFR 基因的胆管癌,预计长期治疗会有更好的反应。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话