欢迎光临吉康旅!
2019 年库存
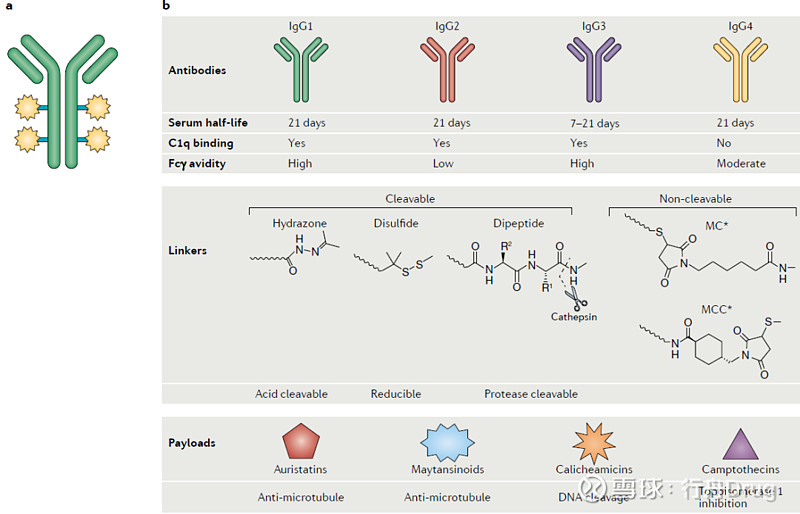
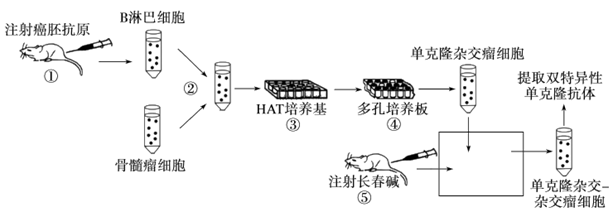
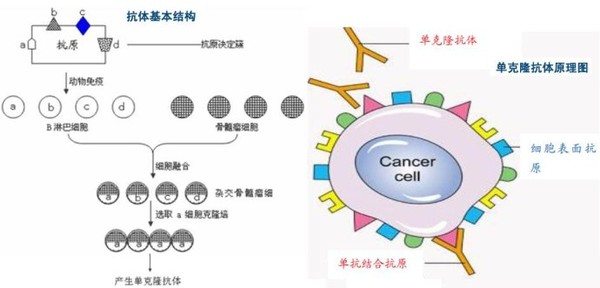
单克隆抗体药物
近年来,PD-1、PD-L1单克隆抗体的研发成为国内外TOP药企最热门的靶点,也是国内最具竞争力的创新药研发赛道。未来。随着2018年特瑞普利单抗和信迪单抗的上市,国产PD-1单克隆抗体实现零突破。2019年以来,一批国内外新型单克隆抗体药物和良药陆续上市,国产生物类似药实现零突破,有效提高了临床药物可及性,更好地满足了公众对生物治疗药物的需求。
伊洛尤单抗注射液
产品名称:瑞百安
通知企业:Inc. ()
2018年7月31日,伊洛鲁单抗获国家药监局批准,成为国内首个获批用于治疗成人或12岁以上青少年纯合子家族性高胆固醇血症(HoFH)的抑制剂。2019年1月24日,安进公司宣布,国家食品药品监督管理总局批准了埃洛尤单抗用于治疗成人动脉粥样硬化性心血管疾病的第二个适应症,以降低心肌梗塞、中风和冠状动脉血运重建的风险。
数据显示, 可以通过抑制前蛋白转化酶枯草杆菌蛋白酶/9 型 () 与低密度脂蛋白 (LDL) 受体 (LDLR) 的结合来增加能够清除血液中 LDL 的 LDLR 的数量。它可以显着降低心血管疾病患者的LDL-C水平[6],从而降低心肌梗死和中风的风险。
注射用贝利木单抗
产品名称:贝利通
申报企业:(英国葛兰素)
注射用 是世界上唯一用于接受标准治疗的活动性自身抗体阳性 SLE 成人的系统性红斑狼疮 (SLE) 药物。
红斑狼疮是一种以免疫炎症为特征的自身免疫介导的结缔组织病,属于皮肤病。SLE 是最常见的狼疮类型,约占所有狼疮病例的 70%。它是一种慢性自身免疫性疾病,涉及多个系统、多个器官以及多种自身抗体的出现。目前,没有完全治愈的方法。
是第一个 B 淋巴细胞刺激因子 (BLyS) 抑制剂,这是一种重组的完全人源化 IgG2λ 单克隆抗体,可与可溶性 BLyS 以高亲和力结合并抑制其活性。根据药物研究数据,该药物可实现疾病的持续控制,有助于稳定长期症状,改善患者的长期预后。目前,很少有现有的 SLE 治疗方案和未满足的临床需求。贝利木单抗联合标准疗法治疗自身抗体阳性成人活动性 SLE 具有良好的获益风险比。该产品的获批填补了我国在上述领域的治疗空白。
达雷妥尤单抗注射液
产品名称:兆科
申报公司:- NV(强生)
达雷妥尤单抗是强生公司研发的人源化、抗CD38单克隆抗体药物,于2015年11月16日首次与FDA共同开发,作为复发/难治性多发性骨髓瘤患者的四线治疗药物,是世界首个获批用于治疗多发性骨髓瘤的单克隆抗体。于2019年7月4日获得国家食品药品监督管理局批准。
达雷妥尤单抗通过补体依赖的细胞毒作用(CDC)、抗体依赖的细胞介导的细胞毒作用(ADCC)和抗体依赖的细胞吞噬作用(ADCP)与肿瘤细胞表达的CD38结合,以及多种免疫相关机制如Fcγ受体诱导肿瘤细胞凋亡。
国家食品药品监督管理总局有条件地批准了该产品的进口注册申请,用于成人复发难治性多发性骨髓瘤患者的单药治疗,包括一种蛋白酶体抑制剂和一种免疫调节剂,这些患者曾接受过既往疾病进展治疗的患者。它的推出将为复发和难治性多发性骨髓瘤患者提供新的治疗方法。
杜瓦鲁单抗注射液
产品名称:英飞凌
研发公司:英国(阿斯利康)
度利木单抗注射液于2019年12月6日获得国家食品药品监督管理局批准,是国内首个也是目前唯一获批上市的PD-L1免疫抑制剂。它用于治疗铂类药物。用于治疗化疗和放疗后未出现疾病进展的不可切除的 III 期非小细胞肺癌 () 患者。
根据国家癌症中心2019年发布的全国癌症统计数据,肺癌在我国恶性肿瘤发病率中位居首位,是当前肿瘤防治的重点疾病。临床试验结果显示,同步放化疗后使用度伐鲁单抗注射液免疫治疗可使III期不可切除非小细胞肺癌患者的死亡风险降低近32%,中位无进展生存期(PFS)为16.8个月,3年总生存率(OS)率为57%。
替雷利珠单抗注射液
产品名称:白泽安
研发公司:百济神州
2019年12月28日,百济神州发布公告,其抗PD-1抗体药物“百泽安”上市申请获国家药监局批准,用于治疗复发或难治性经典型患者至少二次线全身化疗。霍奇金淋巴瘤 (R/R cHL) 患者。该药也是新修订的《药品管理法》实施后,我国首个获得上市许可持有人批准上市的创新生物药。.
据悉,是一种人源化IgG4抗PD-1单克隆抗体,旨在避免与巨噬细胞表面的FcγR受体结合,激活巨噬细胞的吞噬作用,减少其对巨噬细胞的影响。T-效应细胞的负面影响,临床试验客观缓解率为76.9%。此前,另一项替雷利珠单抗用于既往治疗过的局部晚期或转移性尿路上皮癌(UC)患者的新适应症申请已被药评中心受理并获得优先审评。
利妥昔单抗注射液
产品名称:汉力康
申请企业:上海复宏复宏汉霖生物制药有限公司
生物仿制药是指在质量、安全性和疗效上与注册参比药相似的治疗性生物制品。近年来,随着重磅生物药专利到期,生物类似药成为药企的热门领域。全球生物类似药市场规模处于快速增长阶段,增速远超原研生物药。
原研药利妥昔单抗(商品名:)于1997年获得美国食品药品监督管理局(FDA)的批准,是世界上第一个用于治疗癌症的单克隆抗体。2000年引进我国,成为我国治疗非霍奇金淋巴瘤的首选。“汉力康”是国内首个按照生物类似药途径开发申报的参比药产品,获得国家重大新药创制与技术重大专项支持。2019年2月22日获批上市。治疗霍奇金淋巴瘤。
阿达木单抗注射液
产品名称:荣耀
申请企业:百科生物制药有限公司
该产品是国内首个获批的阿达木单抗生物类似药,主要用于治疗类风湿关节炎、强直性脊柱炎、银屑病等自身免疫性疾病。
原研药阿达木单抗注射液(商品名:修美乐)是全球首个获批上市的全人源抗肿瘤坏死因子单克隆抗体。2002年在美国获批上市。修美乐在全球获批适应症多达14个,连续多年成为全球销量第一的生物制剂。“格乐利”于2019年11月4日获批上市,为中国患者提供更多临床用药选择。
贝伐单抗注射液
产品名称:安科
申请人:齐鲁药业有限公司
原研药贝伐单抗( )是采用重组DNA技术制备的人源化单克隆抗体IgG1。它与人血管内皮生长因子 (VEGF) 结合,抑制 VEGF 与其受体的结合,并阻断血管生成。抑制肿瘤细胞生长的信号转导途径。贝伐单抗由基因泰克公司开发,于2004年2月26日获得美国食品药品监督管理局(FDA)的批准,自此作为重要的抗血管生成药物之一被广泛应用于各种恶性肿瘤的治疗。
“安凯”于2019年12月6日获批上市,主要用于治疗晚期、转移性或复发性非小细胞肺癌和转移性结直肠癌患者。这是中国首个获批的贝伐单抗。单克隆抗体生物仿制药。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话