欢迎光临吉康旅!
2019年8月,恩曲替尼获FDA批准用于ROS1融合阳性患者和NTRK融合阳性实体瘤。到目前为止,两种激酶抑制剂已用于 NTRK 基因融合阳性实体瘤。 是第一个获批用于 NTRK 患者的激酶抑制剂,但没有直接比较 和 。在疗效的临床试验中,值得注意的是,最近发表在《柳叶刀肿瘤学》上的两项荟萃分析表明,恩曲替尼的颅内活性与全身活性相当[1],详情如下:
恩曲替尼对ROS1阳性的疗效分析
01
背景
基因融合是许多癌症类型的致癌因素。 ROS1 融合见于 1-2%。多达 36% 的 ROS1 融合阳性患者在诊断为晚期疾病时有脑转移,许多患者随后发生颅内转移,克唑替尼被批准用于 ROS1 融合阳性治疗。然而,克唑替尼的中枢神经系统(CNS)渗透性较差,在接受克唑替尼治疗的近一半的 ROS1 融合阳性患者中,CNS 是第一个也是唯一一个疾病进展的部位。这一事实表明,目前迫切需要具有强颅内活性的新型 ROS1 抑制剂。
是一种多激酶抑制剂,靶向 ROS1、肿瘤原肌球蛋白受体激酶 (TRK) A/B/C 和 ALK。在临床前研究中,恩曲替尼的体外活性是克唑替尼的 40 倍。
02
方法
本研究是对三项正在进行的恩曲替尼前瞻性研究(ALKA-372-001、-1 和 -2))的综合分析。可评估人群为局部晚期或转移性 ROS1 融合阳性成人每天至少接受一次口服恩曲替尼 600 mg 且随访至少 12 个月的患者。所有患者的 ECOG PS 评分为 0 至 2,允许招募有治疗经验的患者(ROS1 抑制剂)。终点是客观反应率和反应持续时间。
03
结果
该研究包括 53 名未接受过 ROS1 抑制剂治疗的 ROS1 融合阳性患者。 ALKA-372-001于2012年10月26日至2018年3月27日入组,-1于2014年8月7日至2018年5月10日入组,-2于2015年11月19日入组,为本研究的截止日期是 2018 年 5 月 31 日。
在可评估人群中,77%(41/53) 名患者)有反应,其中 72% (38) 有部分反应,2% (1) 有稳定的疾病。大多数接受 的患者的目标病灶出现疾病消退(图 1A),包括基线时有 CNS 转移的患者(图 1B)。伴侣类型之间对治疗的反应没有差异,21 名 CD74-ROS1 融合患者中有 18 名(图 1B)。 86%) 有反应,相比之下,非 CD74-ROS1 融合患者中有 13 人 (65%) 和 12 名未鉴定的融合型患者中的 12 人中有 10 人 (83%)。 CD74-ROS1融合和非CD74-ROS1融合和未知融合类型患者的中位治疗时间分别为14.6个月、14.2个月和21.分别为 5 个月。
在基线时有 CNS 转移的 20 名患者中,11 名(55%)有颅内缓解,大多数可测量的颅内病灶有疾病消退(图 1C),基线时可测量的 CNS 病灶和无在恩曲替尼之前接受放射治疗 2 个月以上,71% (5/7)) 的患者有颅内反应率,2 名 (29%) 患者没有颅内反应。缓解。颅内缓解率为80%(4/5).
在恩曲替尼前接受放射治疗 <2 个月的患者中)。
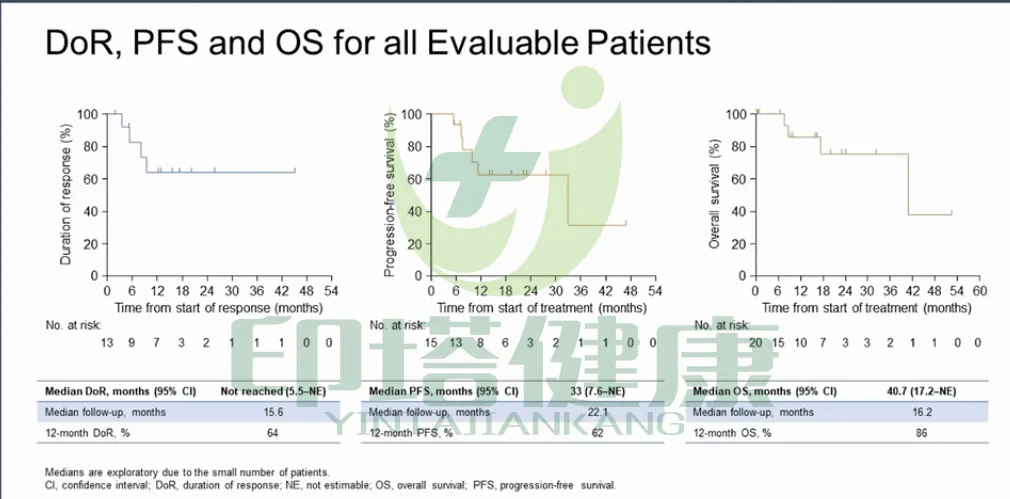
图1 恩曲替尼疗效分析
在 41 名可评估人群中,独立盲法中央评估的中位反应持续时间为 24.6 个月(图 2A),中位 PFS 为 19 个月(图 2B)。 ),20 例基线脑转移患者的中位 PFS 为 13.6 个月,中位颅内缓解持续时间为 12.9 个月,中位颅内 PFS 为 7.7 个月. 30 例基线无脑转移患者的中位 PFS 为 26.3 个月(表 1),未达到中位 OS(图 2C)。
表1疗效结果分析
在数据截止时,中位随访时间为 15.5 个月,34%(18/53) 患者出现 CNS 疾病进展,未评估 CNS 进展的中位时间(图 2D)。)。
图2生存分析
01
结论
在 ROS1 融合阳性患者中显示出持久的疾病控制活性,耐受性良好,安全性可控,适合长期给药。研究数据表明需要对 ROS1 融合进行常规检测。
恩曲替尼治疗NTRK实体瘤的疗效分析
01
背景
NTRK是一种致癌驱动基因,是许多肿瘤的潜在治疗靶点,包括肉瘤等。该融合基因最初发现于结直肠癌,约0.3%的实体瘤患者中发现。 NTRK融合基因和TRK蛋白在不同肿瘤中的表达不同。 TRK激酶抑制剂目前正在开发中,2018年,被FDA批准用于NTRK基因融合且无已知耐药突变的实体瘤。然而,只有少数 CNS 患者对 有反应。此外,尚未报道对 的颅内客观反应率和反应持续时间。因此,对于 NTRK 融合阳性肿瘤患者的 CNS 活性仍然存在未满足的药物治疗。需要。
本研究旨在在三项研究中评估恩曲替尼对转移性或局部晚期或不可切除的 NTRK 患者(包括 CNS 疾病患者)的疗效。
02
方法
本研究是对三项正在进行的恩曲替尼前瞻性研究(ALKA-372-001、-1 和 -2))的综合分析。转移性或局部性晚期 NTRK 融合阳性成人患者至少接受每天口服 1 剂 600 mg,随访至少 12 个月。所有患者的 ECOG PS 评分为 0 至 2 分,且既往接受过抗肿瘤治疗(TRK 抑制剂除外)。主要终点是客观缓解率和响应持续时间。
03
结果
ALKA-372-001于2012年10月26日至2018年3月27日入组,-1于2014年8月7日至2018年5月10日入组,-2入组时间为2015年11月19日,本研究的截止时间为2018年5月31日。中位随访时间为12.9个月。该研究包括 54 名晚期或转移性 NTRK 融合阳性患者。在可评估人群中,51 (94%)、2 (4%) 和 1 例 (2%) 来自 -2、-1 和 ALKA-372-001 研究。大多数患者是融合或融合,最常见的融合类型是 ETV6–,见于 46% (25) 的患者,其次是 TPM3– (4, 7%) 和 TPR– (4, 7%)。主要肿瘤类型为肉瘤(13例,24%)、(10例,19%)和唾液腺乳腺分泌癌(7例,13%)。
在可评估的54例患者中,客观缓解率为57%,4例(7%)患者达到完全缓解,27例(50%)患者部分缓解,9例(17%)患者病情稳定(表1 )。 1).
表1疗效分析
从治疗开始到疾病进展的任何时间点,54 名患者的总体反应最好(图 1A)。
融合和融合患者的缓解率相似,分别为 59% (13/22) 和 58% (18/31)。只有 1 (2%) 名患者融合,对恩曲替尼无反应。
分析中包括的所有肿瘤类型都有反应,包括 6 例 (86%) 唾液腺乳腺癌、5 例 (83%) 乳腺癌、7 例 (70%) 患者、2 例 (67%) 胰腺癌、6 例(46%) 肉瘤、1 (25%) 名结直肠癌和 1 (20%) 名甲状腺癌患者(图 1A)。此外,对恩曲替尼的反应几乎与融合伙伴无关。
图1各种肿瘤类型的反应率
中位缓解持续时间为 10 个月(图 1B,C),29 名患者在数据截止时出现疾病进展或死亡,中位 PFS 为 11 个月(图 2A),中位预测 OS 为 21月(图 2B)。
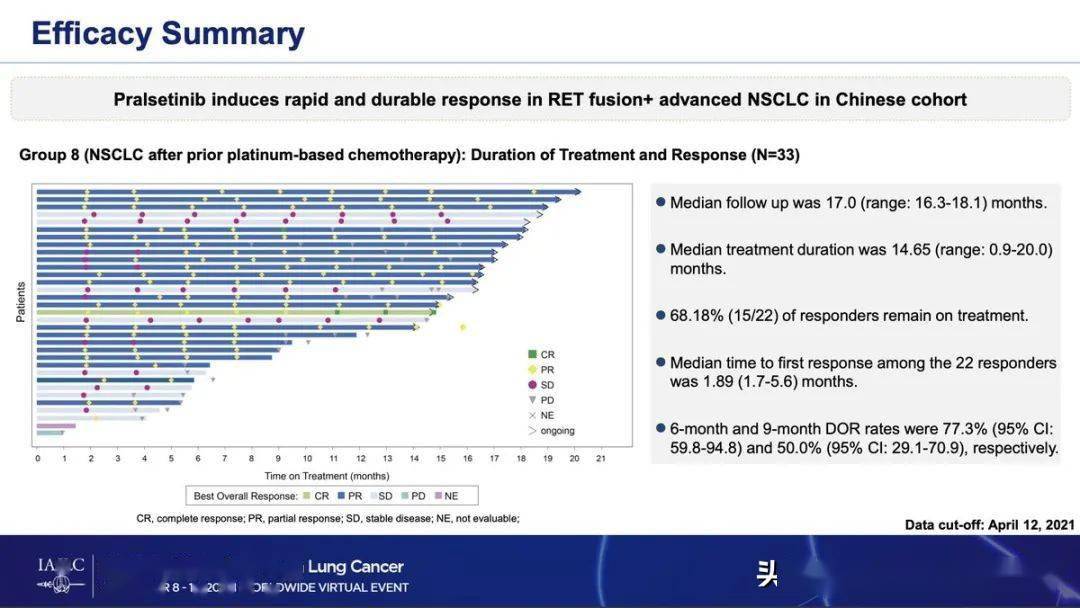
图2生存分析
在 22%(12/54)基线时患有 CNS 疾病的患者)中,6 人(50%)实现了部分缓解,4 人(33%)疾病稳定(图 3A),在基线患者结局相似,无 CNS 患者的 ORR 为 60%,4 名(10%)患者完全缓解,21 名(50%)患者部分缓解。 54例患者中17例出现CNS疾病进展,中位至CNS进展时间为17个月。
20%(11/54)患者)在基线时有脑转移,其中 6 名(55%)有颅内反应(图 3B)。
图 3 基线时有和无中枢神经系统疾病患者的疗效分析
64% (7/11) 的患者接受过既往放疗。未达到颅内缓解的中位持续时间,颅内进展的中位时间为14个月。
04
结论
汇总分析结果表明,恩曲替尼在包括CNS转移在内的NTRK融合阳性实体瘤患者中显示出良好的临床活性和安全性。
参考文献
[1] U. 用于 ROS1 - 和 NTRK - 。 . 2020;21(2):193–194.doi:10.1016/-2045(19)-2
[2] A、S、R 等人。在 ROS1 - 非细胞肺中: 1-2 [ 在 . 2020 年 2 月;21(2):e70]. . 2020;21(2):261–270.doi:10.1016/-2045(19)-4
[3] RC,A,Paz-Ares L 等人。 in with or NTRK - : of 1-2 [ in . 2020 年 2 月;21(2):e70]. . 2020;21(2):271–282.doi:10.1016/-2045(19)-6返回搜狐,查看更多
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话