欢迎光临吉康旅!
正文 | 陈
肺癌是全球发病率和致死率最高的癌症之一,约占所有肺癌的 80-85%。尽管我们看到各大药企在这一领域积极布局,从小分子靶向治疗到肿瘤免疫治疗,并实施各种合作战略加速市场渗透,但显然后期药物治疗的版图越来越丰富。
IO一线疗法争夺市场
对于无特定突变的患者群体,PD-1/PD-L1 IO疗法已证明联合化疗或与其他免疫疗法联合一线治疗的有效性。
2016 年,默沙东成为首个获批用于 PD-L1 TPS ≥ 50% 的单药一线治疗的 IO 疗法。与含铂化疗组相比,5年中期OS率为31.9%,mOS分别为26.3个月和13.4个月在对照组。-042 还证明了对 PD-L1 表达≥1% 的患者群体的生存益处。
默沙东的临床管线
接下来是 BMS,与默克一样,它一直在努力将 推向一线治疗。2020年,ASCO公布了纳武利尤单抗联合低剂量易普利姆玛(O+Y)双免疫治疗不化疗的III期研究一线治疗三年随访数据更新。与化疗相比,它们都为一线转移性疾病带来了持久和长期的生存益处,无论患者的PD-L1表达水平如何(<1%或≥1%),患者都可以受益。3 年 OS 率为 33%、29% 和 22%。
另一项减少一线化疗周期的-9LA III期研究,O+Y+2个周期的化疗vs常规4个周期的化疗,显示免疫联合组的中位OS明显优于化疗组( 15.@ >6 个月 vs 10.9 个月,HR:0.66),减少化疗周期的效果还在。和-227 研究一样,不管患者PD-L1表达、O+Y联合限程化疗可提高OS。
因此,2020年5月,O+Y无化疗和O+Y+化疗治疗组合均获美国FDA批准用于PD-L1>1且无EGFR/ALK突变的患者一线治疗。新的突破,但安全问题仍然比较令人担忧。
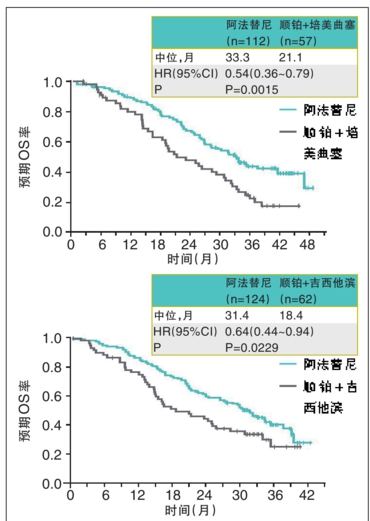
与之前提到的公司相比,罗氏在该领域早已是资深玩家,管线布局更为广泛。 的研究结果表明,在一线治疗 PD-L1 ≥ 50% 的肿瘤患者中,与化疗相比, 将中位 OS 延长 7.1 个月(20.2 个月 vs 13.1个月,HR=0.59),2020年5月也获得美国FDA批准用于该适应症。
罗氏临床管道
国产PD-1 mAb也在紧随其后,恒瑞的成为首个获批的鳞状细胞癌一线治疗药物,将成为2021年1月首个获批的非鳞状细胞癌一线治疗药物,基于—— 307研究。此外,信达生物的和的PD-L1单克隆抗体用于一线治疗的上市申请也在审核中。
现在是热门的免疫靶点,而目前进展最快的是罗氏2020年发表的联合治疗PD-L1阳性患者的临床研究结果,与只接受治疗的患者组相比,+PD-L1联合治疗有明显改善: ORR 分别为 31.3% 和 16.2%;PFS 分别为 5.@>4 和 3.6 个月。此外,在 PD-L1 高表达的患者群体中,联合治疗的 ORR 为 55.@>2%,而单独治疗的 ORR 为 17.2%,从而降低了患者的疾病恶化或死亡的风险降低了 67%。紧随其后的是 MSD 的 MK-7684 和 BMS 的 BMS-。
ALK 和 EGFR 抑制剂的迭代
辉瑞的研发管线已经有与德国默克公司合作开发的PD-L1单克隆抗体,但该药上市较晚,仅获默克尔批准。细胞癌和肾细胞癌、尿路上皮癌。2020年9月,当基石药业的PD-L1舒格利单抗完成III期临床试验联合含铂化疗用于晚期一线治疗时,基石药业获得了其在中国大陆的商业化权,以弥补相对落后的发展。中国市场上的PD-1抗体。此外,辉瑞以成功的 ALK 融合靶向治疗的迭代药物开发而闻名于该领域。
辉瑞临床管线
第一代 ALK 抑制剂克唑替尼在临床试验中显示出良好的疗效,约 60% 的患者达到缓解,中位 PFS 为 8 至 10 个月。但约30%的ALK阳性患者先天对克唑替尼耐药,其余70%在治疗约1年后对克唑替尼表现出不同程度的耐药。产生药理耐药的主要原因是克唑替尼难以穿透血脑屏障,而生物耐药主要是由于药物靶点和ALK信号通路的改变。药物靶点的变化包括ALK激酶区域突变(28%)和ALK融合基因拷贝数扩增。约30%~45%的患者在克唑替尼治疗后会出现ALK激酶区域突变和ALK融合基因拷贝数扩增。
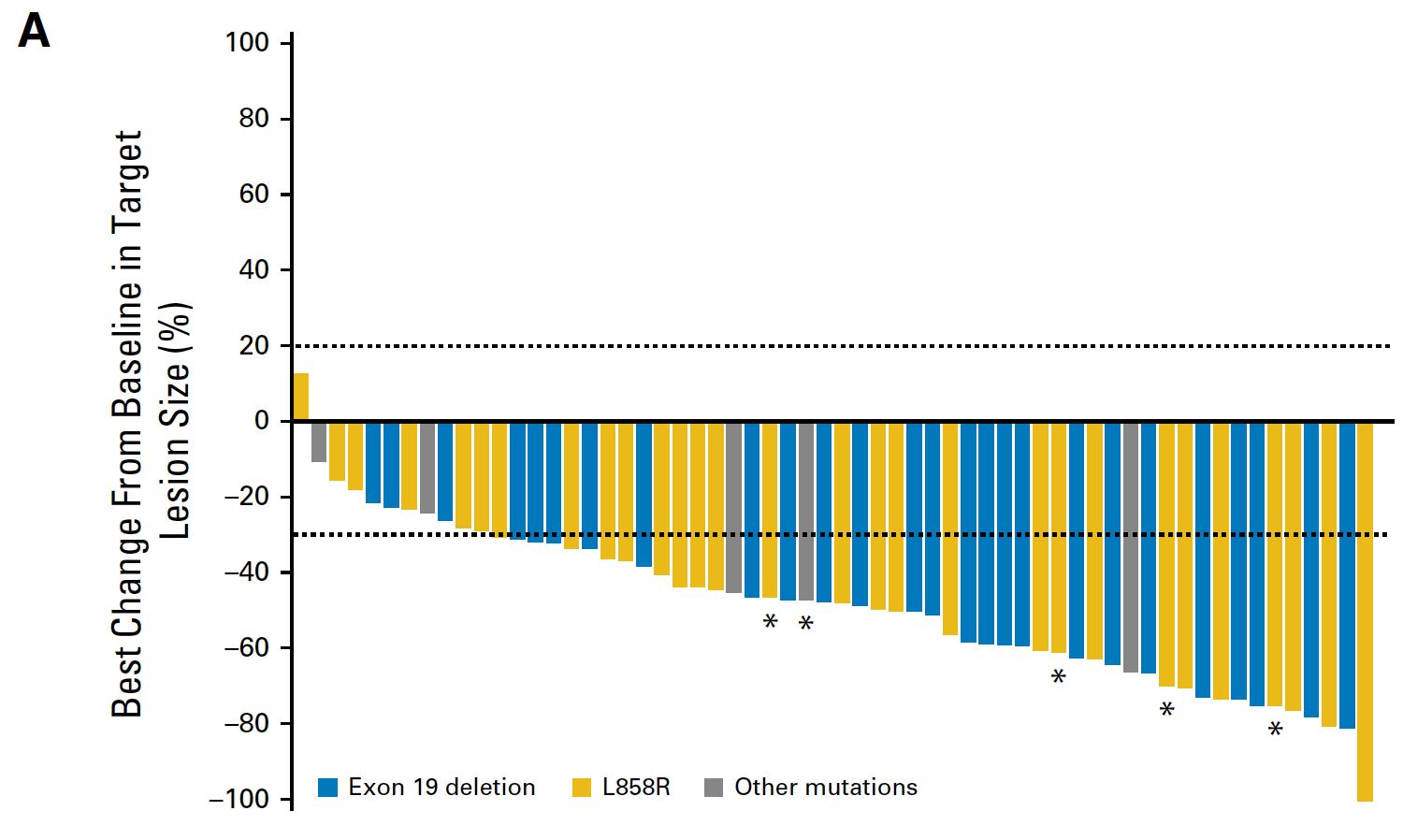
随后辉瑞研发了第三代ALK抑制剂劳拉替尼,具有ALK/ROS1双重抑制作用,可有效穿越血脑屏障,深入中枢神经系统。2018 年 9 月在日本首次获批用于耐药性 ALK 融合阳性晚期和/或复发性疾病。2020年,ESMO还宣布了劳拉替尼与克唑替尼在晚期ALK阳性一线治疗中的III期研究。未达到 vs 9.3 个月),将疾病进展或死亡的风险降低多达 72%。值得一提的是,劳拉替尼组颅内客观缓解率高达82%,克唑替尼组高达23%。
AZ的PD-1抗体药物在中国采取了不同的做法,已获批用于III期肺癌。通过 EGFR TKI 的迭代,它仍然可以保持在中国的市场地位。EGFR突变占全球的10%~35%,其中约50%在中国。% 的患者有 EGFR 基因突变。当其研发的第一代EGFR TKI吉非替尼成为EGFR靶向治疗的一线标准治疗药物时,开启了晚期精准治疗的时代。后来发现,接受第一代药物治疗后的患者中约有60%是由EGFR突变引起的。耐药性,所以AZ也成功研发了奥希替尼。名为奥希替尼的III期试验也让奥希替尼进入EGFR突变的一线治疗。
阿斯利康临床管线
此外,还有与第一三共合作开发的HER2-ADC药物。虽然HER2-ADC的主战场将是乳腺癌和胃癌,但在该领域也值得开发。II 期将于 2020 年在 ASCO 公布。 - 公布 HER2 过表达或 HER2 突变非鳞状细胞患者的研究结果,ORR 为 61.9%,DCR 为 90.5% ,中位 PFS 为 14 个月。一个积极的结果可能会导致在更大的 HER2 表达低的人群中更快地开始研究,这一直是一个空置的市场。
HER2在各种癌症类型中的表达率
新目标攻击
其他研发管线的一部分是现有靶点药物的迭代,包括EGFR突变人群的细分,如强生的第三代EGFR-TKI和EGFR和cMet双抗体,这两种药物的联合可以考虑阻断更多的。EGFR耐药机制。

EGFR突变率
可通过血脑屏障进入中枢神经系统,对EGFR耐药机制有抑制活性,包括T90M等,对cMet和EGFR突变有抑制活性,包括外显子19缺失和外显子20插入,2020年的结果Esmo 发表的名为 ORR 的试验对 20 名 EGFR 突变初治患者为 100%,对 45 名奥希替尼耐药患者为 36%。强生现在已经启动了一项名为 头对头的 III 期试验,+ vs. vs. EGFR 突变但不需要 MET 突变的患者。当然,AZ 也被部署来应对这一挑战。在已完成的研究中,奥希替尼和萨沃替尼联合治疗第三代 EGFR-TKI 初治患者的 ORR 为 65%。
联合治疗的疗效
武田的TAK-788也是新一代EGFR-TKI,旨在选择性靶向EGFR外显子20插入突变,仅占人群的2-3%左右。药物作为外显子插入突变患者的最后一线治疗,mPFS可达7.3个月,ORR为23%。在同一领域也有主要竞争对手。在-1试验中,单药作为外显子插入突变患者的后线治疗,ORR为18.3%。
另一部分是新目标的探索。最流行的一种包括靶向 KRAS G12C 突变。它目前似乎比安进的疗效更好,但它的毒性也更大。后者已向 FDA 和 EMA 提交了营销申请。最近发现亚洲人中 KRAS G12C 的突变率远低于白种人,分别为 3.6% 和 13.8%。
I/II 期试验中两种 KRAS 抑制剂的人群比较
赛道依旧拥挤,协同研发正在加速。例如,诺华自身PD-1抗体开发缓慢,收购百济神州上市的PD-1抗体药物,默沙东从大冢子公司获得临床前SHP2抑制剂。药物开发权,更多的联合疗法仍在探索中。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话