欢迎光临吉康旅!
另一种生物仿制药正在市场上。
近日,由绿叶医药集团控股子公司博安生物研发的抗肿瘤生物药布诺®(贝伐单抗注射液)正式上市。
®是博安生物开发的首个获批用于治疗晚期、转移性或复发性非小细胞肺癌和转移性结直肠癌的生物类似药。未来,博安生物还将拥有多个生物类似药和创新药。
博安生物总裁兼首席运营官窦长林博士表示,目前,博安生物在研产品均为自主研发,在研项目已对外授权。据了解,博安生物已开发出10余款具有国际知识产权保护的创新抗体,以及博诺®等8种生物类似药,并围绕细胞治疗等前沿技术领域积极布局。
博安生物首个抗体药物上市
博宇诺®是一种靶向血管内皮生长因子(VEGF)的重组人源化免疫球蛋白G1(IgG1)单克隆抗体),可结合VEGF-A并抑制其与VEGF受体-2的相互作用(-2)结合,进而抑制 VEGF 的生物学作用,包括影响血管通透性、增殖和内皮细胞迁移和存活,并持续抑制肿瘤血管生成、生长和转移。
作为全球重磅抗靶药,贝伐单抗也登上了全球热销药物排行榜,与美罗华、赫赛汀并驾齐驱,是罗氏单克隆抗体的三大巨头。根据罗氏财报,2019年阿瓦斯汀全球销售额约为74.9亿美元,同比增长3.3%;而其2019年在中国的销售额为15.55亿元,同比增长55.6%。

博安生物、复宏汉霖、正大天晴等本土企业也纷纷布局。随着2018年贝伐单抗专利保护期满,有齐鲁药业、信达生物等,贝伐单抗生物类似药已获批上市。
博安生物的®获批适应症用于治疗晚期、转移性或复发性非小细胞肺癌和转移性结直肠癌。根据世界卫生组织国际癌症研究机构(IARC)的数据,2020年中国新发癌症数量位居世界第一,达到457万,占全球新发癌症的23.7%案例。直肠癌是我国癌症新发率最高的两种癌症类型。2020年新增病例将分别约为82万和56万,大量用药需求尚未得到满足。
未来,博宇诺®将有更大的适应症拓展空间。作为抗肿瘤血管生成的代表药物,贝伐单抗已被纳入全球各种恶性肿瘤治疗指南推荐的标准方案。目前在中国,贝伐单抗被批准用于治疗结直肠癌、非小细胞肺癌、胶质母细胞瘤和肝细胞癌。在全球范围内,贝伐单抗的适应症还包括卵巢癌、宫颈癌、肾细胞癌和其他实体瘤。
博宇诺®于5月7日获国家药监局批准,商业化布局自此迅速扩大。博安生物CEO蒋华表示,博安生物拥有完整完整的产业链,将通过自身的业务团队、商业资源和网络,提升核心市场患者的药品可及性;另一方面,博安生物选择与阿斯利康合作,授权其在中国21个省、市、自治区的县域独家推广博诺®。推广该产品以进一步造福更多患者群体。
目前,生物类似药具有广阔的市场空间。以贝伐单抗为例,由于纳入医保目录,并与免疫类药物联合使用,贝伐单抗有望实现量增、市场快速增长,其中生物类似药将占据半壁江山。据&报告,2023年中国贝伐单抗整体市场规模有望达到131亿元,2018-2023年复合增长率为32.7%,2030年进一步增至177亿元其中,生物类似药市场预计2023年将达到64亿元,2019-2023年复合年增长率为343.5%,2030年进一步增至99亿元,占据更多超过整体市场的一半。
除了此次获批上市的博诺®,博安生物还有7个生物类似药项目进展顺利。其中,(®生物类似药)和(®生物类似药)已在中国进入临床比较试验(3期临床试验),在欧美进入1期临床试验;(® 生物类似药) 也已进入中国比较试验阶段(临床三期)的临床试验。
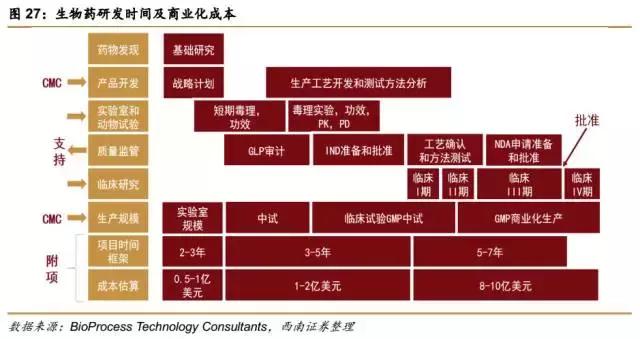
创新生物药布局
事实上,生物仿制药的可用性大大增加了药物的可及性。业内也有一些关于生物仿制药与其他技术相结合的讨论。例如,在之前的CBI生物仿制药峰会上,就讨论了生物仿制药单克隆抗体(如利妥昔单抗)与CAR-T技术的结合。可能性。将生物仿制药与 CAR-T 疗法相结合不仅可以降低它们的成本,而且还可以成为生物仿制药制造商区分其产品的一种有吸引力的方式,而结合技术的使用可能会提高单克隆抗体的疗效。
生物仿制药也为部署的公司带来了回报。例如,2019年复星医药汉力康获准在中国上市,成为国内首个生物类似药,首个适应症为非霍奇金淋巴瘤。获批后,新的生产规模( )将迅速增加。2020年年销售收入7.5亿元,新患者使用比例超过50%。
除了汉利康,复星医药还布局了多款生物类似药。但值得注意的是,复星医药的生物创新药也是其主力军。在研发创新布局上,研发管线正在逐步扩大。
梳理后发现,在创新药的布局中,有多家企业同时提到了生物类似药的布局。姜华还强调,生物类似药只是博安生物布局的一个领域。“贝伐单抗只是博安生物的一个起点,我们的立足点在于创新药。”
目前,博安生物主要布局在三大领域。一是基石领域,主要以上述生物类似药为主;另一个是旗舰领域,主要以创新生物药为主。CD3/CEA双特异性抗体等;三是特色领域,以新兴疗法为主,注重差异化,在研管线包括CAR-T细胞疗法产品。
以创新生物药新型冠状病毒中和抗体LY-为例。于今年4月在《》子刊发布阳性研究成果,并于今年5月完成国内一期临床试验,安全性和耐受性良好。博安生物计划近期在美国、欧洲和中国开展LY-的2期临床试验。
窦昌林进一步指出:“我们在上述领域有不同的研发策略。对于生物类似药,我们是全球布局的。目前,全球有很多生物类似药在临床试验;对于创新生物药,我们希望另外,我们选择的目标不是没有任何依据的,而是没有经过充分验证的目标,但已经有一些研究可供参考,以降低我们的开发风险。我们也在积极部署新一代的未来的创新技术。”
截至目前,博安生物已经建立了完整的抗体开发体系,涵盖了从靶点验证、抗体药物发现和开发、CMC的全过程,确保了高抗体质量、高开发速度和低供应商依赖。已建成全人源抗体转基因小鼠及噬菌体展示技术平台、双特异性T细胞技术平台、抗体药物偶联物(ADC)技术平台三大技术平台。
上述-19中和抗体LY-利用全人源抗体转基因小鼠和噬菌体展示技术平台。该平台筛选出的抗体无需经过传统的抗体人源化过程。从蛋白免疫到中和抗体的获取,短短50天,研发速度大大提高。此外,LY-设计有特殊的Fc序列,可以避免抗体依赖性增强的发生,即避免加剧细胞因子风暴,从而提高抗体药物的安全性和临床成功率。
窦长林解释说:“首先,我们正在研发的很多肿瘤产品来自全人源抗体转基因小鼠和噬菌体展示技术平台,这是博安生物自主研发的具有自主知识产权的知识平台。第二,我们有也是双特异性T细胞技术平台。在双抗体产品类型中,我们主要专注于制作针对CD3及相关肿瘤靶点的双抗体,形成竞争优势。此外,第三个技术平台——抗体药物偶联(ADC) )也取得了一些不错的进展,我们的产品线中也有一款ADC产品即将进入临床应用阶段。”
据了解,博安生物在两年左右的时间里完成了60多个临床研究中心、648名入组患者的III期临床研究,这是目前国内规模最大的贝伐单抗类似物III期临床研究。的。
博安生物的布局也获得了资本的青睐。2021年初,博安生物在一个月左右的时间里,共获得了多家投资机构约8亿元的融资。投资方包括建银国际、史带、元盛创投等,是国内国际知名机构,投后估值56亿元。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话