欢迎光临吉康旅!
颅脑照射的晚期并发症
放疗的并发症包括急性和晚期反应。
急性反应被定义为从放射治疗时间到放射治疗后 6 周发生的反应。晚期反应是在放疗结束后 6 周或更长时间发生的反应。与可逆的急性和早期反应不同,晚期反应是不可逆的。
辐射效应可分为对脑血管结构的影响和对神经胶质细胞及其前体如干细胞的影响。此外,辐射引起的炎症和血脑屏障破坏也直接或间接导致细胞破坏。
研究发现,内皮损伤可能在单次推注后的前 24 小时内发生。确切的机制是未知的。但内皮细胞凋亡似乎起主要作用。
实验还发现,辐射直接作用于几种细胞系的质膜,激活酸性鞘磷脂酶,产生神经酰胺并引发细胞凋亡。内皮破坏可导致继发性血脑屏障破坏和其他延迟的血管反应,例如毛细血管扩张、微血管扩张和增厚,以及血管壁的玻璃样化。因此,放射治疗后数月或数年可能会发生缺血性中风或脑出血,例如微出血。
放射性坏死的危险因素包括受照射的正常脑组织体积、总辐射剂量、照射时间表、伴随药物和潜在的患者间变异性。
小于 5 岁的患者和老年人发生辐射引起的脑损伤的可能性增加。伴随化疗也可以显着影响放射毒性的发生和严重程度。例如,接受全脑放疗和化疗的原发性中枢神经系统淋巴瘤患者发生严重认知障碍的风险很高。
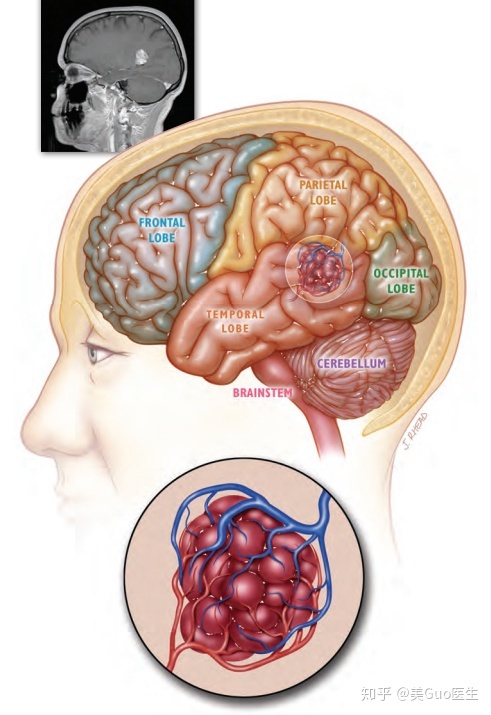
诊断
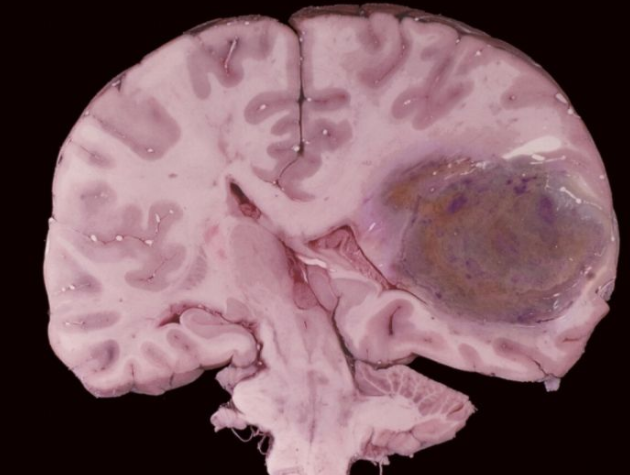
放射性坏死和肿瘤复发之间的区别是相当困难的。常规 MRI 通常呈现增强病变,在原始肿瘤和/或高剂量靶标内或周围立即出现中央坏死和反应性水肿。这种成像特征与大脑中原发性高级别脑肿瘤和脑转移瘤完全重叠,使得放射性坏死图像的解释具有挑战性。
常规影像学上更提示放射性坏死的特征包括 T2 影像学上没有明确的占位性病变,以及高水肿增强体积比。当水肿和病灶体积随时间的自发改善与活动性肿瘤不一致时,检测时机最有帮助,这表明存在放射性坏死。
相反,影像学特征的非特异性恶化与这两种情况有关。
灌注加权 MRI 显示与放射性坏死相关的脑血流量减少,活动性肿瘤很可能是脑血流量增加。弥散加权 MRI 上的阻断扩散提示有活动性肿瘤。
PET 上 FDG 或蛋氨酸摄取增加或 PET 上氯化铊 201 摄取增加提示肿瘤,而缺乏摄取提示坏死。
最终,需要对可疑病变进行活检以明确诊断,尤其是那些症状严重且影像学进行性恶化的病变。
对待
在许多情况下,放射性坏死是一种自限性过程,可通过保守治疗解决。在那些有症状的病例中,中等剂量的地塞米松(4 至 8 毫克/天)通常会立即产生症状改善。一旦症状得到控制,剂量将需要慢慢减少。
对激素没有反应的人,或者症状改善后不减少激素的人,对其他方法持怀疑态度。例如,抗凝治疗、抗血小板治疗和高压氧治疗都报告了少数病例的益处。
有时需要手术切除放射性坏死,尤其是在诊断不确定时。手术可以通过减少占位效应和术后激素使用来立即缓解症状。
微创激光基质内消融是一种探索性治疗选择。
回顾性研究和小型随机临床试验发现,贝伐单抗可以改善选定病例的脑放射性坏死症状和影像学检查(7.5 mg/kg,间隔 3 周,共 4 个治疗周期)。
总结
●颅脑照射是治疗原发性和转移性脑肿瘤以及某些类型白血病的一个组成部分。
●颅脑放疗可以杀死脑血管结构、神经胶质细胞及其前体细胞。炎症和血脑屏障破坏也可间接导致细胞损伤。
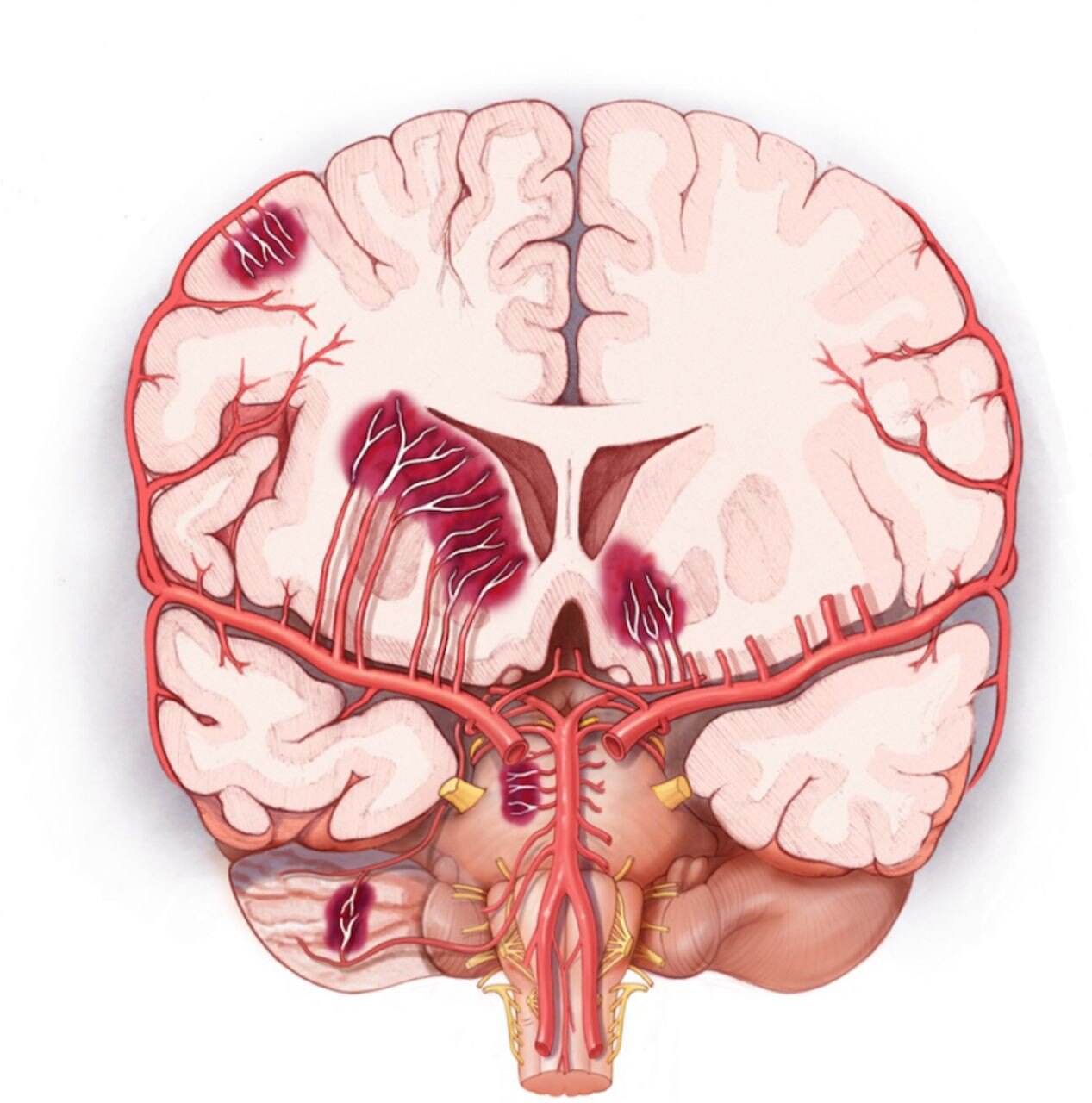
●放射性坏死是一种严重的并发症,常发生于放疗后1~3年,有时发生至10年。症状取决于病变的位置,包括局灶性神经功能缺损或颅内压升高的全身症状和体征。每次放疗的高剂量会增加放射性坏死的风险。治疗通常是对症的。贝伐单抗可用于对类固醇反应不佳的严重病例。
随着时间的推移,局部和全脑放疗都与一些患者的神经认知能力下降有关,而这种认知能力下降不太可能是由其他原因引起的,例如肿瘤本身、手术和化疗、同时使用抗癫痫药物。
●颅脑照射与许多脑血管并发症有关,包括类似烟雾病的阻塞性血管疾病、缺血性中风和可导致脑出血的脑海绵状血管瘤。
●颅脑照射的其他晚期并发症包括白内障、视神经病变、干眼症、视网膜病变、耳毒性和内分泌病变。
●颅脑照射后,脑膜瘤、胶质母细胞瘤、神经鞘瘤等继发性肿瘤的风险增加。儿童颅脑或颅脑脊髓放射治疗的幸存者患脑和骨髓肿瘤的风险增加。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话