欢迎光临吉康旅!
嘉宾:同济大学附属上海肺科医院:周才村教授、苏春霞教授
四川大学华西医院:陆游教授、张艳教授
武汉大学人民医院:宋启斌教授、彭敏教授
吉林省肿瘤医院:6月13日,程英教授团队邀请周才村教授、陆游教授、宋启斌教授等多位知名人士为大家带来“肺癌直播间”的POST ASCO专场。第一手资料信息,碰撞出与同行专家的思维火花。本期内容邀您重温专家之争,深入剖析肺癌靶向治疗新进展。如果图文看不爽,文末有直播链接,可查看完整视频。
ALK通路治疗肺癌
艾乐替尼
艾乐替尼加克唑替尼一线治疗 ALK+ 的真实世界研究
作为第一代ALK-TKI,克唑替尼已于2012年取代铂类疗法成为ALK+的一线治疗标准,PFS=10.9个月。第二代 ALK 抑制剂艾乐替尼在一线临床研究中实现了 34.8 个月的 PFS,在连续克唑替尼治疗失败的患者中实现了 8.9 个月的 PFS。
日本是艾乐替尼最早上市的国家,艾乐替尼一线治疗的真实OS结果会给大家带来更多的启发。该研究共招募了 840 名患者,在 OS 结果的真实世界研究中将一线克唑替尼与一线艾乐替尼进行了比较。
艾乐替尼的真实世界一线治疗 PFS 结果达到 40.11 个月,克唑替尼达到 9.13 个月。艾乐替尼一线治疗与克唑替尼一线治疗的 OS 结果存在显着差异。0.549 “0.414-0.441”,P<0.0001)。
真实世界研究 PFS 结果
真实世界研究操作系统结果
总结:
一线克唑替尼和二线艾乐替尼序贯治疗组的结果如何?
真实世界一线艾乐替尼PFS达到40.11个月,OS结果与一线克唑替尼有显着差异。一线艾乐替尼的 ORR 显着高于二线艾乐替尼
序贯克唑替尼组的ORR高于一线克唑替尼组的总体人群,说明这部分ALK-TKI反应良好的患者在序贯治疗组更为丰富
一线克唑替尼可接受序贯治疗的OS可达88.44个月,一线艾乐替尼治疗组未筛查患者的OS趋于优于序贯治疗组
布加替尼
III 期,ALTA-1L 临床研究:布加替尼与克唑替尼/非亚洲数据的回顾性分析
ALTA-1L 研究(ALK in Lung of 1st Line)是一项多中心、开放标签、随机 III 期研究,旨在比较布加替尼与克唑替尼在未接受 ALK 抑制剂治疗的 ALK 阳性晚期患者中的疗效和安全性。
ALTA-1L 研究相关结果
总结:
在亚洲和非亚洲人群中先前未接受过 ALK 抑制剂治疗的 ALK+ 患者中,与克唑替尼相比,布加替尼的 PFS 改善趋势相似
在亚洲和非亚洲人群的基线脑转移患者中, 的颅内缓解率和颅内 PFS 均优于克唑替尼
两组对布加替尼的耐受性良好
在亚洲人群中,布加替尼组中 AST 和 ALT 升高的患者百分比在数值上较高;然而,两组中布加替尼组的剂量调整率相似
可能是 ALK+ 患者非常有前景的一线治疗选择
II期临床研究,布加替尼序贯二代ALK抑制剂疗效结果
研究 - 连续其他 ALK 抑制剂多中心真实世界研究
血液DNA检测
第二代ALK抑制剂治疗后血液ALK突变的纵向比较
该研究收集了 81 名患者的 103 份血液样本。所有样本中 ALK 点突变的发生率为 64%。血液样本和组织样本的结果相似(66% 对 63%)。更需要基因检测,因为突变的概率更高,而且劳拉替尼耐药性比二代ALK抑制剂多,多点突变多于2个或3个。
在ALK突变的序贯治疗过程中,需要重新检测或动态监测血活检,以发现后续耐药突变,以帮助后续治疗。
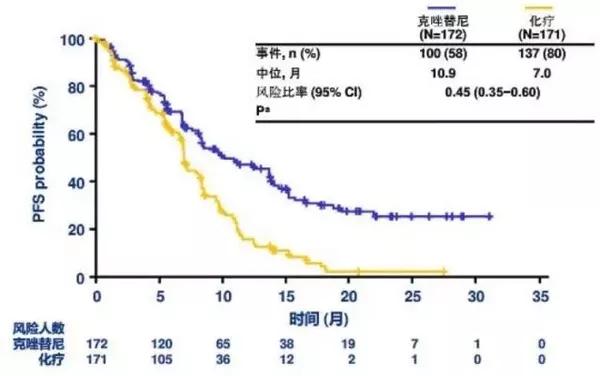
(主讲人:苏春霞教授)
互动讨论
1. 随着越来越多的ALK-TKI临床研究结果发表,您会采用哪种方法进行克唑替尼、艾乐替尼、布加替尼的序贯治疗?怎么排队?
2. 您认为NGS/液体活检在ALK 通路治疗的整体管理中有何价值?你会如何应用它?
周才存:布加替尼未来能否进入一线治疗,将取决于其PFS。如果布加替尼的 PFS 超过 60 个月,可能更有可能进入一线治疗。相反,艾乐替尼对布加替尼一线耐药后无效。也预计艾乐替尼将在今年的医保谈判中惠及更多患者。
宋启斌:ALK-TKI的部署主要基于三个方面:一是PFS,艾乐替尼一线治疗的PFS为34.8个月,遥遥领先于其他ALK-TKI;第二个是PFS。这是一种耐药机制。ALK的耐药机制有四种:点突变、扩增、转化为小细胞肺癌等机制。30%的第一代ALK-TKI为点突变,50%~70%的第二代ALK-TKI为点突变。第三代更多的是复合突变。当耐药突变集中在少数基因位点时,有利于后续的药物选择。因此,应首选艾乐替尼和布加替尼。三是副作用的发生率,包括肝损伤等。在ALK通路的全程管理中,NGS/液体活检的价值也是从耐药机制上考虑的。第一代ALK-TKI患者中仅有30%存在点突变,突变的存在与否并不能显着提高患者的ORR和PFS。NGS/液体活检意义不大;但二代和三代ALK-TKI在一线治疗耐药后的突变位点差异较大,NGS/液体活检具有重要意义。
程英教授团队:就疗效而言,不同的ALK-TKI存在显着差异。艾乐替尼 34.8 个月的 PFS 明显高于克唑替尼和色瑞替尼,创造了单药一线治疗 PFS 最长的记录,而日本的真实世界数据也表明第二代ALK-TKI艾乐替尼的OS优于第一代克唑替尼。目前,布加替尼的PFS尚未达到,一年的PFS率是克唑替尼的1.5倍,劳拉替尼的研究也在进行中。
EGFR通路治疗肺癌
EGFR通路单药治疗进展
TAK-788
TAK-788 是一种口服研究性 EGFR/HER2 抑制剂,其 I/II 研究调查了 TAK-788 在 EGFR 外显子 20 插入患者中的安全性和有效性。
TAK-788相关研究成果
总结:
TAK-788 160 mg QD 在 EGFR 外显子 20 插入突变的患者中具有抗肿瘤活性。所有患者(包括脑转移瘤)的 ORR 为 43%,PFS 为 7.3 个月
TAK-788 的不良反应可以与其他 EGFR TKI 的 AE 一致地进行管理
HER3抗体偶联药物U3-1402
大约 57-67% 的 EGFR 突变患者携带一定程度的 HER3 蛋白表达。为此,日本第一三共制药开发了HER3抗体偶联药物U3-1402。
U3-1402 相关研究背景
截至2019年2月25日,共纳入23例患者,均为IV期,19例患者进行肿瘤组织中HER3表达检测,阳性率为100%。
23 名患者接受了四种剂量水平的 U3-1402(3.2、4.8、5.6、6.4 mg/kg),其中 16 名可用于评估,所有患者均出现肿瘤缩小,肿瘤控制率为100%,3例患者有效时间超过9个月,中位无进展时间和总生存期尚不成熟。
不良反应方面:绝大多数不良反应为1-2级,仅3例为3-4级与治疗药物相关的不良反应,1例为3级恶心,2例为4级血小板减少(均< @6. 4 mg/kg 剂量),没有患者因不良反应死亡。
U3-1402 治疗相关数据
EGFR通路联合治疗进展
: 厄洛替尼联合雷莫芦单抗治疗初治 EGFR 突变转移的多中心、双盲、随机、全球 III 期临床研究。
该研究是一项针对一线治疗的 III 期 RCT 研究,包括 EGFR 敏感突变 (, ) 患者,但不包括脑转移患者。随机分为联合治疗组和厄洛替尼单药治疗组,主要研究终点是研究者评估的 PFS。
结果显示,联合组和单药组的PFS分别为19.4个月和12.4个月,P<0.0001。在数值上优于以前的联合治疗研究。
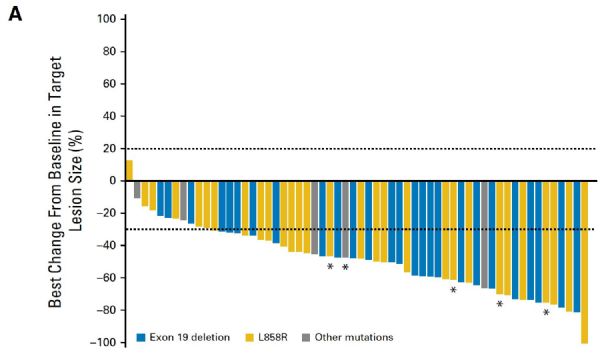
研究相关结果
该研究还观察了耐药后突变的发生率,联合组VS单药组为43% VS 47%,两组间无统计学差异。因此,联合治疗不影响治疗耐药后第三代TKI的使用。联合组患者的 PFS 超过 19 个月。
突变率
常见的不良反应有高血压、皮炎、腹泻和肝功能异常。导致停止治疗的严重不良事件占2.26%,单药组为1.78%。没有出现意外的不良反应,表明联合治疗是安全的。
安全相关结果
总结:
雷莫芦单抗联合厄洛替尼显着延长 PFS,HR0.591 (0.416, 0.760), mPFS: 19.4 个月 vs 12.4 个月
预设亚组、次要终点分析和探索性分析(DOR、PFS2)一致的临床获益)
雷莫芦单抗联合厄洛替尼在 EGFR 突变人群中的安全性和一致的毒性特征
治疗进展后,两组的EGFR突变率相似
如果获得政府批准,该研究方案将成为治疗 EGFR 突变初治转移患者的新选择
吉非替尼与吉非替尼联合培美曲塞和卡铂治疗晚期未经治疗的 EGFR 突变,一项随机 III 期研究
吉非替尼联合化疗的 III 期研究结果
总结:
吉非替尼+培美曲塞+卡铂组与吉非替尼单药组相比PFS延长8个月(16个月vs 8个月),HR0.51(95%Cl,0.39-0. 66),P<0.001
吉非替尼+培美曲塞+卡铂组18个月总生存率较吉非替尼单药组提高30%,(78.3% vs 48.7%)
治疗毒性方面,≥3级临床相关不良事件发生率:吉非替尼+化疗组50.6%,吉非替尼单药组25.3%,两组有统计学差异(P<0.001)
吉非替尼+培美曲塞+卡铂或成为EGFR突变的一线治疗新选择
奥希替尼联合贝伐单抗一线治疗EGFR突变阳性晚期的II期临床研究
2016 年 8 月至 2018 年 5 月,共有 49 名患者入组本研究,其中 35 名确诊为 CNS 转移患者。
截至 2019 年 4 月 15 日,所有入组的 49 名患者均可进行疗效评估,总缓解率(ORR)为 80%(PR 39,SD 9,NE 1),中位无进展生存期为 1< @8.4 个月。
(主讲人:彭敏教授)
互动讨论
1.单药VS联合模式:晚期EGFR患者一线治疗,您更喜欢哪种模式?
2. EGFR TKI 一线组合有哪些应用前景和优势?
周才存:治疗初期,如果患者有混合性鳞癌/肿瘤负荷大,EGFR-TKI单药治疗效果不佳,应采用二药或三药联合治疗;对于 SD 或 SD 缓慢或持续增加,也可以考虑联合治疗。
陆宇:EGFR单药应用的几个节点——治疗1个月、3月、6月的疗效评价需要特别注意。如果疗效评价不好,需要考虑联合治疗模式。该组合的前景和优势主要针对早期进展的EGFR阳性患者。
苏春霞:今年ASCO给了我们很多新的灵感。其中,A+T模式对胸腔积液、心包积液、腹水,甚至脑转移的患者都能起到很好的抗肿瘤作用。反应耐受性良好,A+T模式下耐药突变概率与既往EGFR单药治疗接近,后续序贯第三代EGFR-TKI治疗没有问题。总而言之,应用单药或联合模式应根据患者的基线水平、经济状况、药物可获得性、毒副作用等综合考虑。
罕见的肺癌靶向治疗
肺癌罕见靶向治疗新进展
抑制剂 AMG 510 在晚期实体瘤中的 I 期研究
AMG 510:新型、一流的小分子抑制剂。作用机制:明确且不可逆转地将 KARS 锁定在非活动的 GDP 绑定状态。目前的 I 期研究评估了局部晚期或转移性阳性实体瘤患者的安全性、抗肿瘤活性和药代动力学。
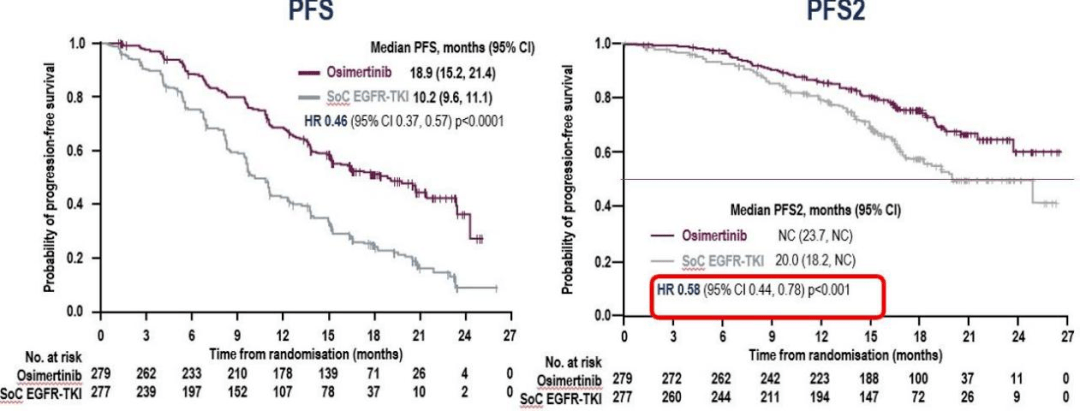
AMG 510 在晚期实体瘤中的 I 期研究结果
总结:
在 I 期试验中,AMG 150 表现出良好的安全性、有效性,包括阳性实体瘤患者的 PK 数据。
所有剂量水平均未发生剂量限制性毒性 (DLT)、4 级或严重或累积毒性。
AMG 150 血浆浓度超过临床前模型中肿瘤生长抑制的浓度阈值
5/10 患者的初步抗肿瘤活性达到 PR(4 例确诊),所有患者在数据截止时都在接受治疗。
治疗晚期 ROS1 融合非小细胞肺癌的安全性和初步临床活性(-1 项研究)
(TPX-0005)是新一代广谱TKI,可抑制ROS1、TRK和ALK的活性。它可以克服多种对其他TKI产生耐药性的基因突变,杀死ROS1或多种与 NTRK 基因融合的肿瘤细胞因此具有治疗 ROS1 阳性细胞的潜力。
一线治疗:研究发现,在TKI- ROS1阳性患者中,达到的总体反应率(ORR)为82%,达到的剂量为83%,颅内反应率高达100%。
一线治疗数据
二线治疗:对于既往接受过ROS1抑制剂治疗的ROS1+非小细胞肺癌患者,有效率仅为27%,而有效率可达39%。如果患者过去仅接受过一线治疗,且使用剂量大于每天 160 mg,则其 ORR 提高至 55%;如果患者之前只接受过一线克唑替尼,反应率可能高达 57%。
二线治疗数据
治疗外显子突变的 II 期临床试验
是一种高度选择性的 MET 抑制剂,在这项正在进行的单臂 II 期研究中,通过非小细胞肺癌患者的 LBx 或肿瘤/组织活检 (TBx) 突变确定。
研究设计
迄今为止,已经招募了 85 名患者(55 名 LBx 测试和 52 名 TBx 测试)。在数据截止时(2018 年 10 月 16 日),在 35 名可评估的 LBx 患者中(≥2 名患者在基线后评估或因任何原因停药),IRC 的 ORR 为 51.4%,INV 为 63.@ >9%。在 41 名可评估的 TBx 患者中,IRC 的 ORR 为 41.5%,INV 的 ORR 为 58.5%。表中显示了治疗线的中位反应持续时间 (mDoR) 和 ORR。
研究相关数据
在 69 名患者中,≥10% 的患者经历了任何级别的治疗相关不良事件 (TRAE),并且没有发生 4 级治疗相关的不良事件或死亡。
安全结果
BLU-667治疗晚期RET融合的疗效和安全性
BLU-667 是一种选择性 RET 靶向药物,该 ASCO 摘要包括来自试验的更新数据。共有 79 名具有 RET 融合的患者被纳入,中位数为 2 条先前的治疗线,其中 39% 有脑转移。
在可评估疗效的 48 名患者中,ORR 为 58%,DCR 为 96%。疗效与之前的治疗方案和 RET 融合亚型无关。在颅内疗效方面也观察到脑转移的减少。安全性很好。
BLU-667 相关研究结果
对于RET融合,BLU-667是近年来新兴的靶向药物,疗效满意,期待后期数据。
总结:
KRAS:多西他赛联合曲美替尼在 KRAS 阳性患者中的 II 期单臂研究显示出一定的疗效
KRAS:是第一个小分子抑制剂,I期临床研究显示良好的耐受性和疗效
ROS1:强效ROS1抑制剂,对耐药突变有效,颅内效果好
:对于血液检查或组织检查呈阳性的患者,ORR 约为 50%,mDOR 超过 1 年
RET:Blu-667的ORR在60%左右,颅内控制好,耐受性可以接受。
(主讲人:张艳教授)
互动讨论
1. KRAS、MET等罕见靶点阳性患者是否真正进入精准治疗时代?您会接受常规临床测试吗?
2.您如何看待罕见靶点药物在泛-的应用前景?NGS检测在未来对罕见靶阳性患者的作用?
陆宇:肺癌的基因分型越来越清晰,肺癌可以分为几个不同的亚型进行精准治疗。罕见靶标药物的 III 期研究由于其高效性而不太可能且更有可能获得“孤儿药”批准。罕见靶点药物在泛泛中的应用前景,以ALK突变为例,ALK融合突变不仅限于肺癌,而且仅在肺癌中取得了良好的疗效,因此不同肿瘤的生物学特性并不一致。现在说KRAS突变靶向药物是否可以从肺癌扩展到其他癌症类型还为时过早,但值得期待。
马丽霞:KRAS、MET等罕见靶点需要等到进入精准治疗时代。虽然目前药物ORR数据已经达到50%以上,疗效持久,但罕见靶点的驱动机制仍是完全清楚的。未来的药物选择和人群 药物的选择需要通过大样本研究来验证。同时,稀有靶点药物也可以在泛泛中尽快筛选出肿瘤人群,细化相关药物原理。未来靶向药物进入临床后,多靶点基因检测将成为常规检测,为临床实践和后续治疗提供理论依据。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话