欢迎光临吉康旅!
【导读】编者:李爱华、隋红梅;审稿人:张世谦
前言
上皮性卵巢癌 (EOC) 是女性生殖系统中最致命的癌症。预计2018年美国将有2.20,000例新病例和1.40,000例死亡病例,大多数患者最终会复发。一般来说,根据无治疗间隔(TFI),患者分为铂敏感(从最后一剂铂到复发的时间≥6个月)或铂耐药(复发间隔)
[1]首先质疑这种传统模式有两个原因:一是EOC处理后的监测方法不统一。血清 CA-125 和先进的成像技术比传统的症状/体格检查更敏感,传统的症状/体格检查以前被归类为白金。敏感患者可能被归类为铂类耐药患者,并被排除在铂类治疗或临床试验之外;其次,对EOC分子机制的深入研究,也更新了人们对铂类化疗和靶向治疗的认识[2]。可见,传统的治疗方案似乎并不适应新形势的变化,因此GOG提出使用新的命名法来描述病程[3],根据最后一次铂剂量(TFIp) ), 最后一剂非铂 () 或生物制剂 (TFIb) 重新定义了 TFI。本文综述了继发性肿瘤细胞减灭术 (CRS)、分子特征和治疗应用、与铂类化疗联合以及维持治疗基础的最新数据,并讨论了当前新治疗策略面临的挑战,以及正在进行的探索一线治疗试验。
二次细胞减灭术
对于初次治疗后复发的患者,首先要考虑的是是否需要二次手术干预。多项回顾性队列研究表明,如果CRS能够实现完全切除,生存率将提高[4-7]。OVAR 试验回顾性分析了 267 名患者的人口统计学、CRS 和治疗状态。肿瘤完全切除患者的OS显着延长(45.2个月vs 19.7个月),残留病灶大小影响OS,R0、无残留或腹水量第一次手术
虽然III的最终结果还没有出来,但两项研究的结果在PFS上非常一致:GOG 213研究中完全切除组与化疗组相比的中位PFS为21.4个月vs 16.5个月(HR¼0.68),与III的结论相似。但由于复发病灶被完全切除,PFS结果难以解释。因此, III研究的结果很重要,如果GOG被证实,根据213年OS的结论,CRS可能会被放弃。
分子特性
肿瘤分子分析理论上可以预测抗癌治疗的效果,而这些基因突变可以通过二代测序或免疫组化技术来确定。一般来说,实体瘤的挑战,尤其是EOC中驱动基因突变的精确定位,是靶向治疗成功的关键。其他方面包括:肿瘤在空间和时间上的异质性,途径太多,分子识别困难,治疗药物需要获得监管机构的批准和临床验证。
2.1. BRCA 突变聚(ADP-核糖)聚合酶抑制剂 () g ors BRCA 突变的分子治疗是为 EOC 量身定制的靶向治疗的一个例子。建议所有 EOC 患者进行 BRCA 检测,可为患者提供重要的预后信息,便于制定治疗方案。目前,大多数医生建议进行检测。肿瘤组织检测会因突变逆转而导致假阴性,结果不可靠[13]。随着肿瘤检测和高通量检测的提高,依赖特定基因变化的靶向治疗不再局限于BRC。SOLO-1结果证实,一线化疗和维持化疗后BRCA突变患者的PFS明显改善。所以,BRCA突变的检测将成为标准方法。在复发性 EOC 中应注意这一分子特征 [14]。
2.2 同源重组缺陷过程中的一个重要发现是,除了BRCA,遗传或表观遗传的改变可以通过同源重组阻止双链DNA损伤和修复,从而影响灵敏度。具有同源重组缺陷 (HRD) 的患者应该更喜欢竞争性和非计划。目前的临床问题是复发性EOC患者是否可以选择或贝伐单抗维持治疗?此外,研究发现对BRCA野生型和HRD阴性患者的治疗也有统计学意义,但影响程度不如BRCA或HRD阳性队列。那么,对于没有DNA修复缺陷的患者,有没有更好的治疗策略呢?目前,唯一有效的生物标志物是 g 或突变,
治疗方案
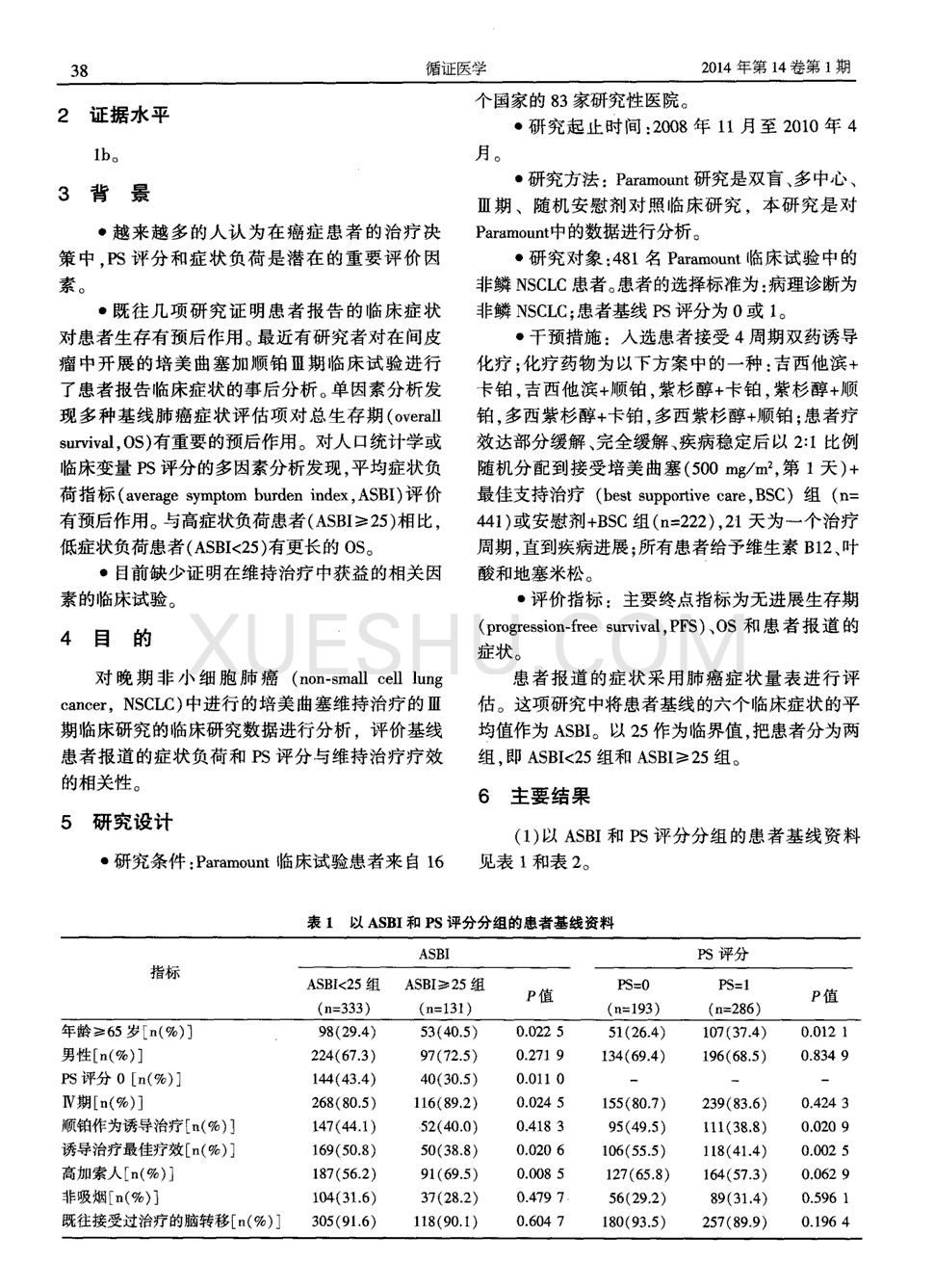
3.1 化疗 对于使用铂类化疗的复发性EOC患者,需要考虑以下几个方面:具体实施、副作用、单药或双药联合、疗效(见表1).与铂类化疗相比)与基础方案相比,其他化疗药物没有优势,这在MITO 8研究中得到了验证。MITO 8研究对象为6-12个月TFIP患者,随机分为铂类化疗组和非铂类化疗组。研究终点是 OS,非铂类化疗没有生存获益(21.8 个月 vs 24.5 个月;HR¼1.38;95%CI0. 99-1.94;P¼0.06)[15]。
它是一种来源于海洋松茸的新型细胞毒药物。作为 DNA 槽结合物,它会导致双链 DNA 断裂。联合脂质体阿霉素(PLD)治疗EOC患者TFIp 6-12个月[16-18],发现单独使用PLD 4个月后PFS明显改善。III 期试验评估了 PLD 联合 PLD 单独治疗复发性 EOC 患者的疗效(),但该试验因无效而提前终止,结果未公布。() 一项针对 6-12 个月时出现 EOC 的 TFIp 患者的 III 期随机试验,以比较 +PLD 与卡铂 +PLD 的疗效。审判正在进行中。
3.2 EOC治疗后维持治疗终会进展,积极治疗非常必要[20]。维持治疗有两种含义:同种药物维持和换药维持。评价同种药物维持治疗的研究通常设计为化疗联合生物治疗,生物治疗用于维持疾病直至疾病进展或一定时间[10,21,22]。相比之下,维持换药是在诱导化疗达到预期反应后实施新方案,即在铂类化疗4-6个疗程后换用新药[23-26]。此外,许多维持治疗试验允许在 CR 和部分“PR”后启动维持计划。也可以说是PR治疗后的策略“转换”,而不是最纯粹的维持治疗。在这种情况下,患者最终会进展,通常规定要继续治疗进展或出现不可接受的毒性,试验设计要求以OS作为观察终点,以评估最终获益是否。
一些维持治疗药物和方案已有报道,包括抗血管生成(AA)和确定疗效;肿瘤免疫剂,例如抗程序性细胞死亡蛋白-1(PD-1) 或抗程序性细胞死亡) 配体-1(PD-L1))的研究正在进行中。
3.3 抗血管生成治疗相关的肿瘤血管生成驱动因素与 EOC 结果之间的关系已得到充分证明 [27-41]。表2显示了AA药物在大型前瞻性随机试验中的结果[10,21,22,42,43],针对VEGF亚型(如贝伐单抗)或其受体(如西地尼布)的药物研究逐渐深入,一种用于维持治疗的新型 AA 制剂的试验正在进行中 [42]。目前卡铂、贝伐珠单抗(同时用药和维持用药)联合吉西他滨或PLD的结果对比显示:PFS为11.7个月vs 13.3个月(HR¼0.807, 95%CI 0.681–0.956, P¼0.0128),PLD组OS有改善趋势(HR¼0.833 , 95% CI 0.680–< @1.022)。因此,对于选择铂类化疗的复发性EOC患者,PLD/卡铂联合贝伐珠单抗是首选。
3.4 目前有五种类型的程序正在临床应用或研究:、、、 和 。用于治疗复发性 EOC 的单药维持治疗和临床试验正在进行中。尽管三项随机 III 期(NOVA,,,)试验和一项 II 期(19) 试验在设计、纳入标准、患者群体和评估方法上存在差异,但维持治疗的结果完全一致。这些患者首先接受以铂类为基础的诱导化疗,如果治疗有反应,则随机分入本组和安慰剂组,无需在随机化前完成所有诱导化疗,将诱导化疗稳定者排除,归类为贝伐珠单抗。反研究。独特之处在于从试验中收集了达到客观缓解 (ORR) 的患者。这些患者有可测量的病变。正如预期的那样,BRCA 突变体获得了部分缓解(38%)。)。
回顾这些相关的维持治疗和III期临床试验的结果,对于复发性EOC患者和AA方案选择铂类化疗是可能的。疗效观察正在进行中,但目前只有 GOG-0213 证明了 OS 的益处。其他试验将评估一种或两种药物联合肿瘤免疫药物(如抗 PD-1/PD-L1 或 CTLA-4 抑制剂)的疗效。例如: ICON 9 () 是复发性 EOC 在随机 III 期试验中,受试者是接受铂类化疗并获得 PR 或 CR 的患者。随机分为奥拉帕尼单药组或奥拉帕尼联合西地尼布组。主要终点是 PFS,次要终点包括 OS、副作用、健康相关的生活质量和 PFS2,
3.5 肿瘤免疫制剂与贝伐珠单抗联用可能成为治疗复发性EOC的新标准。铂金仍然是改善患者 PFS(两者)和 OS(贝伐单抗)的药物选择。免疫疗法似乎具有潜在价值,但免疫疗法与化疗等新药的最佳组合尚未确定。
免疫逃逸是癌症的常见特征 [44, 45]。超过50%的EOC患者在确诊后可检测到肿瘤浸润淋巴细胞(TILs),是肿瘤免疫药物的有效靶点。TIL 的存在与否也会影响预后 [46]。由于EOC携带广泛的基因突变[47],其对免疫检查点抑制剂的反应相对有限,单药治疗对复发性铂类耐药EOC患者的反应率仅为11%-25%[48- 50]。
免疫检查点抑制剂和其他药物的组合可能会提高受试药物治疗反应的有效性和持久性。药物组合包括:引起DNA损伤的分子制剂、化疗药物和AA。与化疗方案的结合,充分利用了药物对免疫系统的互补作用。化疗可调节树突状细胞,增强肿瘤细胞上MHC1的表达,导致免疫原性细胞死亡;当同时使用铂和紫杉烷药物时,小鼠模型中 TILS 的比例增加 [51,52]。AA联合免疫治疗也有理论依据。VEGF 是一种高效的免疫抑制分子,可直接和间接抑制 T 细胞功能,刺激调节性 T 细胞,抑制树突细胞的功能,诱导异常的肿瘤血管增殖,并减少肿瘤 T 细胞的运输 [44, 53–57]。AA联合免疫疗法治疗非鳞状非小细胞肺癌的安全性和有效性已经得到证实。IV期患者随机分为:卡铂紫杉醇联合维持治疗组和卡铂紫杉醇联合贝伐唑抗维持治疗组,结果显示联合和贝伐单抗组均改善PFS(HR ¼ 0.@ >617; 0.517–0.737; P AA联合免疫疗法治疗非鳞状非小细胞肺癌的安全性和有效性已经得到证实。IV期患者随机分为:卡铂紫杉醇联合维持治疗组和卡铂紫杉醇联合贝伐唑抗维持治疗组,结果显示联合和贝伐单抗组均改善PFS(HR ¼ 0.@ >617; 0.517–0.737; P AA联合免疫疗法治疗非鳞状非小细胞肺癌的安全性和有效性已经得到证实。IV期患者随机分为:卡铂紫杉醇联合维持治疗组和卡铂紫杉醇联合贝伐唑抗维持治疗组,结果显示联合和贝伐单抗组均改善PFS(HR ¼ 0.@ >617; 0.517–0.737; P

3.6 联合化疗较难与化疗联合,均需调整剂量。Oza 比较了紫杉醇 + 卡铂联合奥拉帕尼和单独化疗对铂敏感复发性卵巢癌患者的影响。骨髓抑制严重,需要将卡铂降低至 AUC 4,并将奥拉帕尼降低至 200 mg 每天两次。两组ORR无显着差异,但奥拉帕利维持治疗组PFS明显改善[59]。即使是单药联合化疗也困难重重,骨髓毒性严重,限制了化疗药物的使用[60-63]。
3.7 许多替代铂的非细胞毒性疗法单独用于治疗复发性EOC,适应症为g或s BRCA突变患者。 是首个获批的用于 EOC 突变患者的 3 线治疗药物。对于 PSR 患者,ORR(n = 137) 为 33%,ORR 为 45%,56% 的患者在 6 个月后治疗无进展 [64]。基于两项大型开放标签试验的数据(10和),是第二个获批用于复发性EOC的[65-67],适应症与之前相同,结果的ORR为54%[66]。-2试验旨在确定潜在的有益效果其他“BRCA 样”肿瘤。这些“BRCA 样”肿瘤的 ORR 可达到 30%,中位 PFS 7.1 个月,在汇总和分层分析后,这些患者随后进入-3 试验进行维持治疗[67]。II期临床试验(开放标签,单臂)共纳入463例复发性EOC患者,接受3种Plan治疗,以评估(300 mg po qd)的治疗效果。主要研究终点是 HRD 阳性 EOC 患者的 ORR。结果证实,尼拉帕利单药治疗HRD阳性患者的ORR为29%,反应时间(DOR)9.2个月[68]。主要研究终点是 HRD 阳性 EOC 患者的 ORR。结果证实,尼拉帕利单药治疗HRD阳性患者的ORR为29%,反应时间(DOR)9.2个月[68]。主要研究终点是 HRD 阳性 EOC 患者的 ORR。结果证实,尼拉帕利单药治疗HRD阳性患者的ORR为29%,反应时间(DOR)9.2个月[68]。
未解决的问题是基于铂的化疗的利弊。对于突变型 EOC 患者,一项 II 期随机试验的结果表明,单独使用奥拉帕尼的 ORR 高于 PLD,并且 PFS 没有差异。尽管尚未达到主要优势终点,但 PLD 对患者的疗效已高于预期 [69]。目前 () 和 () (,) 这两项试验正在进行中,以比较单药和医生推荐的化疗方案的疗效。
3.8 靶向药物联合应用越来越多的数据表明:很多单一的靶向药物不足以达到持久的效果,因为靶向治疗具有先天性、获得性和适应性耐药性[70],也不例外,一些带有g或突变的肿瘤没有反应,即使是带有BRCA突变的肿瘤,单药治疗的中位反应持续时间(DOR)也只有8个月[64,67,71,72],支持适应性耐药。因此,探索联合治疗具有重要意义。
联合AA的理论基础是AA在肿瘤微环境中可引起缺氧、促进HRD、引起合成致死[73],这是一种不同于BRCA突变的敏感机制。贝伐单抗或西地尼布联合试验的第一阶段已成功完成[73,74]。奥拉帕尼和西地尼布的II期研究数据显示,无论BRCA状态如何,联合治疗组更成功。 单药 PFS 显着改善(17.7 个月 vs 9.0 个月)。在状态组中,联合治疗的获益最大[75]。一项 II 期随机试验 (,) 正在进行中,以比较紫杉醇、奥拉帕尼、奥拉帕尼/西地尼布和 TFIp 对铂类耐药 EOC 患者的疗效
肿瘤免疫制剂(抗PD-1和PD-L1)联合或AA作为维持治疗或双/三联治疗)也备受关注,目前正在研究中。
讨论
复发性 EOC 患者的治疗计划正在发生变化。首先,基于GOG 213的最新数据,CRS的作用再次受到质疑。在等待III期试验结果的同时,必须慎重考虑手术的价值。其次,尽管过去十年化疗的地位保持稳定,但维持治疗和替代传统化疗的新疗法正在研究中,其适应症取决于分子特征或遗传亚组。因此,对于复发性EOC,应确认肿瘤的分子特征和基因组学,在诊断时进行确认最为理想。
对于铂类治疗后复发患者的维持治疗,可选择AA和两者,但作为初始治疗药物改变的适应证,复发患者的用药也应改变。例如,FDA批准在EOC的初始治疗中选择贝伐单抗在使用前,仍需考虑贝伐单抗对后续治疗的影响[77]。同样,奥拉帕尼用于患者维持治疗的推荐也会影响复发患者的治疗[78,79]。与贝伐单抗不同,目前没有关于先前暴露后重复使用的数据。可见,对于复发患者的治疗选择可能更为复杂。例如,如果患者在使用后复发,或在使用过程中复发,还需要后续的维持治疗吗?使用上有区别吗?正在进行的 OREO 随机 III 期试验 () 旨在回答这些问题,该研究包括在维持治疗后出现进展或复发并对铂类药物治疗有反应并接受奥拉帕利或安慰剂维持治疗的患者。对于 BRCA 阳性患者,作者建议对于既往非使用者,可以选择维持治疗之外,患者的临床因素(如疾病分布、体质、累积毒性等)、分子特征、以及选择治疗计划时必须考虑既往治疗史。该研究包括在维持治疗后出现进展或复发并对铂类药物治疗有反应并接受奥拉帕利或安慰剂维持治疗的患者。对于 BRCA 阳性患者,作者建议对于既往非使用者,可以选择维持治疗之外,患者的临床因素(如疾病分布、体质、累积毒性等)、分子特征、以及选择治疗计划时必须考虑既往治疗史。该研究包括在维持治疗后出现进展或复发并对铂类药物治疗有反应并接受奥拉帕利或安慰剂维持治疗的患者。对于 BRCA 阳性患者,作者建议对于既往非使用者,可以选择维持治疗之外,患者的临床因素(如疾病分布、体质、累积毒性等)、分子特征、以及选择治疗计划时必须考虑既往治疗史。
随着对EOC分子认识的深入,新的治疗方法不断涌现,包括PD-1/PD-L1免疫调节剂,可能在复发性EOC的治疗中发挥作用。虽然 100(高级 EOC III 期随机试验)比较了化疗、化疗后维持治疗、联合化疗和维持治疗 2 年以上的疗效,但中期分析因不依从而提前终止,以及许多其他联合研究与免疫调节剂的结合仍在进行中 [80]。
因此,在这样一个瞬息万变的环境中,对于复发性EOC患者的治疗方案,不应仅仅根据“铂敏感性”和“铂抵抗”来确定。最佳治疗方案。当生物标志物未知时,临床医生如何选择靶向药物加入一线化疗以获得最佳效果?它对复发患者的药物选择有什么影响?
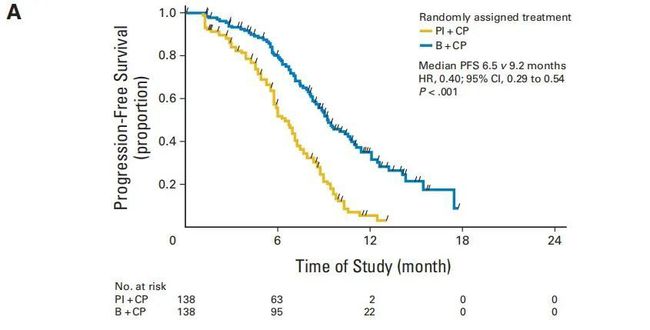
这是一项 III 期随机对照试验,评估 在对铂类一线化疗有反应的 EOC 患者中维持治疗的疗效。主要终点是 PFS;-1也是一项随机III期试验,包括铂类化疗(包括对贝伐单抗有反应的患者随机分为安慰剂维持治疗组、贝伐单抗维持治疗组和奥拉帕尼维持治疗组,以PFS为主要终点。目前100为阴性结果,如果()和-1()得出阳性结论,将改变初治和复发EOC患者的治疗模式。另外NRG-也会分析与化疗的关系. 如果这些研究达到主要终点,
传统的药物研发模式始于“铂类耐药”(PR)组。然而,在利用分子特性进行靶向治疗和实验设计的时代,传统模式已经失去主导地位,EOC治疗领域正在发生快速变化,新疗法不断涌现,转变思维和方式势在必行。治疗模式。
在利用分子特性进行靶向治疗和实验设计的时代,传统治疗模式失去了主导地位,EOC治疗领域正在发生快速变化,新疗法和大量临床试验不断涌现。因此,对于复发性EOC患者的治疗,不应仅根据“铂敏感性”和“铂抵抗”来确定。需要结合患者的分子和基因组特征进行多步骤个体化治疗,探索最佳治疗方案。本文的要点总结如下:
1. GOG 213和随机试验旨在评估CRS的作用,GOG 213问题CRS,III期试验结果待定
2. 对于PSR EOC患者,PLD/卡铂联合贝伐珠单抗为首选治疗,非铂类化疗无生存获益
3. AA联合免疫检查点抑制剂:AA联合治疗IV期、PFS和OS均有改善,PD-L1高表达者获益显着;重复性 EOC 相关试验正在进行中
4. 对于复发性EOC,联合化疗毒性较大,需调整剂量
5. 单药PSR:奥拉帕尼ORR为45%;卢卡帕尼为 54%;II期试验评估尼拉帕利在HRD阳性患者中的ORR为29%; 单药 更高,PFS 无差异
6. 联合 AA:无论 BRCA 状态如何,联合治疗明显优于单药 PFS
7. 复发性EOC患者,AA和维持治疗均可选择,BRCA阳性,无既往使用者,可选择
8. 100未能证明化疗联合免疫调节剂维持治疗的疗效;旨在评估尼卡帕尼维持治疗对铂类一线化疗有反应的EOC患者的疗效,以及-1评估贝伐单抗在这些患者中联合奥拉帕尼维持治疗疗效的试验正在进行中。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话