欢迎光临吉康旅!
-纳武单抗联合易普利姆玛是全球首个也是目前唯一获批用于该适应症的双重免疫疗法-根据-040临床试验结果获批,纳武单抗联合易普利姆玛在该患者人群中的客观缓解率为33%(16/49;95% CI:20-48)[1]- 与 联用)。在全球范围内获得四种癌症治疗方法的批准
普林斯顿,2020 年 3 月 12 日 /美通社/ -- 百时美施贵宝(纽约证券交易所代码:BMY)于 3 月 11 日宣布,美国食品药品监督管理局(Food and Drug ) (FDA) 已批准 1 mg/kg 与 3 mg 联用/kg(静脉注射)用于治疗既往接受过索拉非尼治疗的肝细胞癌(HCC)患者[1],[2]。 FDA 对该适应症的加速批准主要是基于在-040 1/2 期临床试验中观察到的 加 队列的客观缓解率(ORR)和缓解持续时间(DoR)[1],[2], [3]。该适应症的进一步批准可能取决于确认试验中对其临床益处的确认和描述[1],[2]。
“肝细胞癌是一种恶性程度很高的疾病,患者迫切需要多样化的治疗手段[4],[5],[6]。”南加州大学凯克医学院和诺里斯综合癌症中心主任“基于 -040 临床试验结果,在纳武利尤单抗加易普利姆玛队列中观察到的客观缓解率强调了双重免疫治疗对先前患有治疗肝细胞癌[1]。”
-040 临床试验结果显示,经过至少 28 个月的随访[1],纳武利尤单抗和伊匹单抗联合治疗在一组既往接受过索拉非尼治疗的肝细胞癌患者中的客观缓解率为 33 % (16/49; 95% CI: 20-48), 其中 8% (4/49)) 达到完全缓解 (CR), 24% (12/ 49)@ >部分缓解 (PR)[1]. 缓解持续时间 (DoR) 从 4.6 到 30.5 个月或更长时间,其中 88% 的受试者持续缓解至少 6 个月,56 % 持续至少 12 个月,31% 持续至少 24 个月。[1] 上述客观缓解率 (ORR) 和缓解持续时间 (DoR) 由盲法独立中央审查委员会 (BICR) 根据实体确定肿瘤反应评估标准 1. 1 ( v 1.1)[1]。当使用修正的实体瘤反应评估标准 ( ) 评估 BICR 时,客观反应率 (ORR)达到 35% (17/49; 95% CI: 2 2-50),12%的患者(6/49)达到完全缓解,22%(11/49)部分缓解)[1]。
纳武利尤单抗与以下警告和注意事项有关,包括免疫介导的非感染性肺炎、结肠炎、肝炎、内分泌病、肾炎和肾功能不全、皮肤不良反应、脑炎、其他不良反应;输液反应;胚胎-胎儿毒性。此外,当纳武利尤单抗与沙利度胺类似物和地塞米松联合用于多发性骨髓瘤患者时,死亡率可能会增加,因此不建议在对照临床试验之外进行 [1]。请参阅下面的重要安全信息部分,包括 相关免疫介导不良反应的黑框警告,以及 -040 试验中的安全信息。
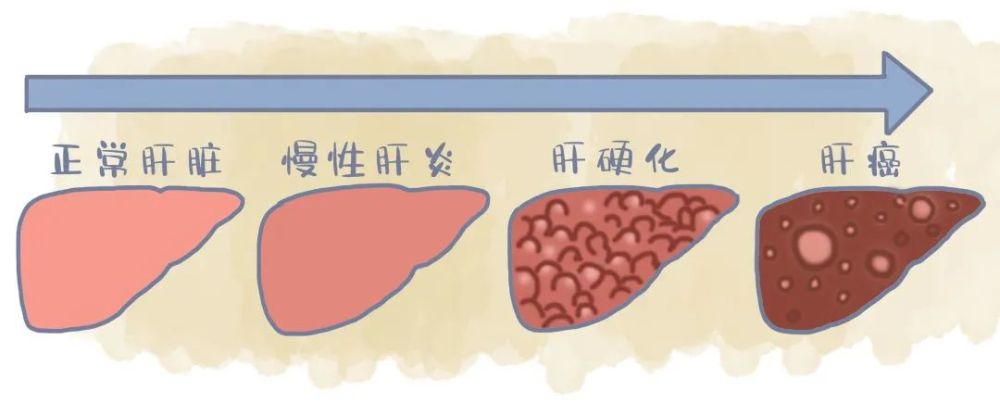
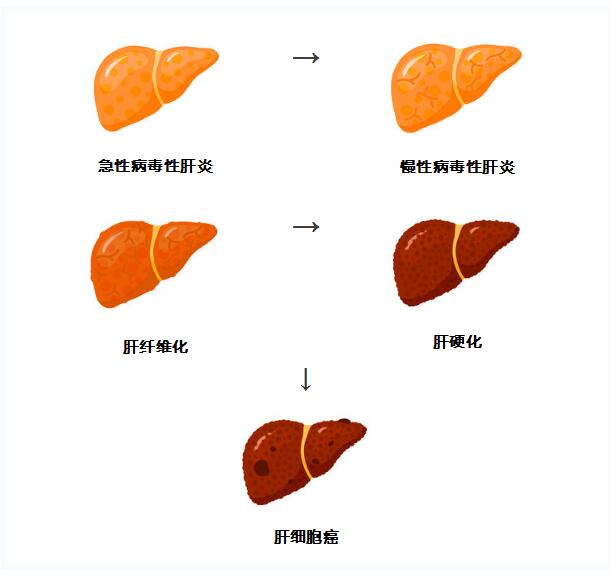
“在美国,肝癌的发病率逐年上升。肝细胞癌是最常见和高度恶性的类型[4],[5],[6],[7],[8],[9]。 “蓝色:肝癌协会主席兼创始人认为,此次获批提供了一种新的治疗选择,给过去曾接受过索拉非尼治疗的肝细胞癌患者带来了更多希望[1]。”
联合易普利姆玛是目前唯一获得 FDA 批准的针对该适应症的双重免疫疗法,通过靶向两个不同的检查点(PD-1 和 CTLA-4)并以互补的方式显示潜在的协同机制[1] .

“我们认为,肝细胞癌等高度恶性癌症患者迫切需要具有临床意义和持久益处的新治疗方案。” - 美国总经理兼肿瘤学、免疫学和心血管病学总经理“这项批准是我们在免疫肿瘤学治疗领域不断开拓和创新的又一遗产,也是我们致力于通过科学改变患者生活的重要一步,”校长亚当说。
此前,纳武单抗联合易普利姆玛已被 FDA 授予突破性疗法认定并优先审查先前治疗的肝细胞癌。
关于-040实验设计
-040 ( ) 是一项开放标签的 1/2 期临床研究,包括 和 的组合,用于治疗先前索拉非尼治疗后进展或索拉非尼耐受的肝细胞癌患者队列 [1]、[10] 本研究包括有和无 PD-L1 表达的患者 [3]。主要纳入标准包括组织学证实的肝细胞癌,肝硬化状态为-Pugh A 级 [1]。其他纳入标准包括活动性 HCV 感染、活动性 HBV 感染或未感染的患者 [1]、[3]。排除标准包括活动性自身免疫性疾病、脑转移、肝性脑病史、临床显着腹水、HIV 感染、活动性 HBV 和 HCV 合并感染,或 HBV 和 HDV 合并感染 [1]。患有已知纤维板层肝细胞癌、肉瘤样肝细胞癌和混合性肝细胞癌-胆管癌的患者也被排除在研究之外 [3]。共有 49 名患者每 3 周接受 4 剂 1 mg/kg(静脉内)联合 3 mg/kg(静脉内),随后每 2 周接受一次 治疗,直至疾病进展或出现无法耐受的毒性 [1] 主要疗效结果是客观反应率和反应持续时间,由 BICR 根据 v1.1 和 [1] [1] 评估。
-040 测试安全信息(摘录)
-040 在 49 名患者中评估了 1 mg/kg 联合 3 mg/kg 的安全性 [1]。接受纳武利尤单抗加易普利姆玛治疗的患者中有 59% 发生了严重的不良反应[1]。 29% 的患者停止治疗,65% 的患者因不良反应延迟治疗[1]。 ≥4% 的患者报告的严重不良反应为发热、腹泻、贫血、AST 升高、肾上腺功能不全、腹水、食管静脉曲张出血、低钠血症、血胆红素升高和非感染性肺炎 [1]。最常见的不良反应(超过 20% 的患者报告)是皮疹(53%)、瘙痒(53%)、肌肉骨骼疼痛(41%)、腹泻(39%)、咳嗽(37%)、食欲下降( 35%))、疲劳 (27%)、发烧 (27%)、腹痛 (22%)、头痛 (22%)、恶心 (20%)、头晕 (20%)、甲状腺功能减退 (20%) 和体重减轻(20%) %)[1]。
*目前,易普利姆玛尚未在中国大陆获批。
文档:
1. 。我们。 。最后:2020.,新泽西州:.
2. 。我们。 。最后:2020.,新泽西州:.
3. Yau T、Kang YK、Kim TY 等。 + in With : 从 040. 于 201 年 5 月 31 日至 6 月 4 日9)0@>
4. R、Sahu MK、A 等人。 : , 和 。 . 2018;5(9)2@>:1-14.
9)4@> S、AL、J 等。带有和的单元格的 .;157:760–779)5@>
9)5@> A、Khan Z、A 等。 : 和 。 2019; 9 (59)7@>:529)5@>
9)9@> KA、AJ 湖、S 等人。至上,第一部分:。 . 2018; 2785-2800.
8. 先知。和胆管, CSR 1975-2019)5@> 25, 2020.
9)0@> 。什么是 ? 25, 2020.
10. 。在 With () 中的 , and of or in With 的一个 -。 7、2012. 21、2020. 25、2020.
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话