欢迎光临吉康旅!
几乎所有靶向药物最终都会产生耐药性,但患者产生耐药性的时间各不相同。有些人服用了几年的靶向药物并且它是有效的。例如,临床工作中经常出现晚期ALK融合突变的非小细胞肺癌患者,可以服用靶向药物5年以上。但不乏在服用靶向药物后几个月内出现疾病进展的患者。携带同样的基因突变,服用同样的靶向药物,结果为何如此不同?抗药时怎么办?
结合突变成为靶向治疗的“绊脚石”
研究发现,靶向治疗疗效不佳的根本原因在于驱动基因突变“不简单”,除了常见的突变外,还结合了其他突变基因。例如,有些EGFR驱动基因不会单独出现,在特殊情况下,会同时出现两个或多个突变位点。而这种情况并不少见,数据显示,在亚洲患者中,20%的EGFR驱动基因存在“合并突变”。
“组合突变”的出现给肺癌患者的治疗带来了很大的困难。本来只要识别出驱动基因,然后用相应的靶向药物精准命中突变位点就足够了,但在“组合突变”的情况下,药物可能无法发挥功效。EGFR突变研究发现28.8%的EGFR敏感突变患者对吉非替尼治疗无效;该研究还发现了类似的发现,在肺腺癌的敏感EGFR突变患者中,厄洛替尼组17%的患者对治疗没有反应。随着研究的深入,研究人员发现除EGFR突变外,最常见的共突变发生在BRAF、MET、TP53、MYC等基因中。特别是,TP53突变可影响EGFR突变肺癌靶向药物治疗后的生存预后。对于接受一线靶向药物治疗的EGFR突变阳性晚期非小细胞肺癌患者,TP53突变的存在导致较低的无进展生存期(PFS)和较差的预后。使用第一代 EGFR 靶向药物治疗后 6 个月内出现进展的患者,其 TP53 突变频率高于 24 个月后出现进展的患者。随后更大、设计更精细的研究不断涌现,进一步证实了共突变对疗效和存活率的影响。在众多共突变中,驱动基因突变和几个重要的抑癌基因(TP53、RB、PTEN等)的共突变逐渐被业界认可。ALK突变 ALK突变也有类似报道。2018年底,《肿瘤学年鉴》报道了一组216例ALK突变晚期非小细胞肺癌患者接受靶向治疗的临床数据。研究发现,约23.8%(约1/4)的ALK突变患者同时携带TP53突变;对于 TP53 突变患者,10.3 个月和中位 OS(15.0 个月对 50.)的中位 PFS 期(3.9 个月)显着缩短@>0 个月);即使在那些接受第二代靶点的患者中,服用该药物的患者仍然如此。也就是说,即使靶向药物升级,共突变对疗效的影响依然存在。报道了一组 216 例 ALK 突变晚期非小细胞肺癌患者接受靶向治疗的临床数据。研究发现,约23.8%(约1/4)的ALK突变患者同时携带TP53突变;对于 TP53 突变患者,10.3 个月和中位 OS(15.0 个月对 50.)的中位 PFS 期(3.9 个月)显着缩短@>0 个月);即使在那些接受第二代靶点的患者中,服用该药物的患者仍然如此。也就是说,即使靶向药物升级,共突变对疗效的影响依然存在。报道了一组 216 例 ALK 突变晚期非小细胞肺癌患者接受靶向治疗的临床数据。研究发现,约23.8%(约1/4)的ALK突变患者同时携带TP53突变;对于 TP53 突变患者,10.3 个月和中位 OS(15.0 个月对 50.)的中位 PFS 期(3.9 个月)显着缩短@>0 个月);即使在那些接受第二代靶点的患者中,服用该药物的患者仍然如此。也就是说,即使靶向药物升级,共突变对疗效的影响依然存在。8%(约 1/4)的 ALK 突变患者也携带 TP53 突变;对于 TP53 突变患者,10.3 个月和中位 OS(15.0 个月对 50.)的中位 PFS 期(3.9 个月)显着缩短@>0 个月);即使在那些接受第二代靶点的患者中,服用该药物的患者仍然如此。也就是说,即使靶向药物升级,共突变对疗效的影响依然存在。8%(约 1/4)的 ALK 突变患者也携带 TP53 突变;对于 TP53 突变患者,10.3 个月和中位 OS(15.0 个月对 50.)的中位 PFS 期(3.9 个月)显着缩短@>0 个月);即使在那些接受第二代靶点的患者中,服用该药物的患者仍然如此。也就是说,即使靶向药物升级,共突变对疗效的影响依然存在。即使在那些接受第二代靶点的患者中,服用该药物的患者仍然如此。也就是说,即使靶向药物升级,共突变对疗效的影响依然存在。即使在那些接受第二代靶点的患者中,服用该药物的患者仍然如此。也就是说,即使靶向药物升级,共突变对疗效的影响依然存在。
MET突变 MET突变也不例外。MET扩增(MET拷贝数高于6)或MET基因外显子14跳跃突变是比较公认的两类潜在驱动基因。目前MET靶点较多,虽然疗效不如与EGFR和ALK靶向药物一样,一项研究调查了289例MET基因外显子14跳跃突变的晚期肺癌患者,外周血同时检测了68个其他常见癌基因突变,超过85%的标本被发现携带其他共突变,平均共突变数为2.74;最常见的共突变为TP53、EGFR、NF1、BRAF、CDK4等,其中近40%的患者同时患有 RAS,RAS信号通路共突变的患者接受了单一的MET靶向药物,疗效更差,生存期更短。上述研究证实,具有其他共突变的患者接受了单一的 MET 靶向药物。靶向药物治疗疗效差,生存时间较短。如何应对耐药性?
一旦耐药,我必须更换药物吗?
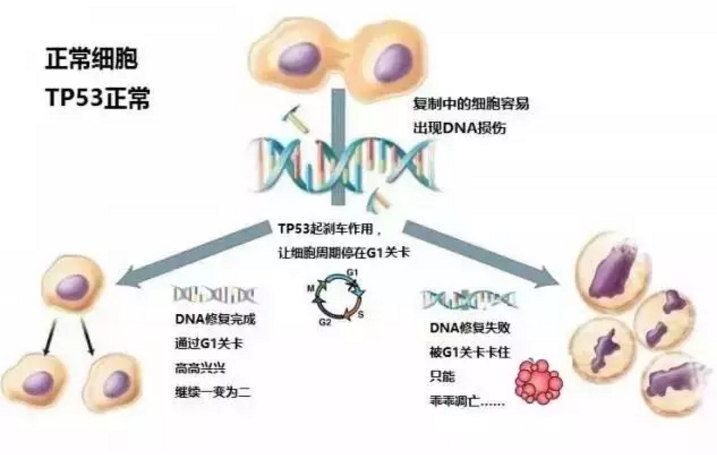
其实两者都是耐药性,程度不同。按耐药程度可分为缓慢耐药、局部耐药和完全耐药三类。针对不同的耐药情况,治疗方法也不同。上海复旦大学附属肿瘤医院邱立新医生提出以下方法。
缓慢抵抗
在这些患者中,CT扫描病灶并没有增加,但肿瘤指标却在增加。在这种情况下,盲目的换药是绝对不可取的。比如EGFR敏感突变的患者,如果在靶向药物吉非替尼治疗期间CT病灶没有增加,但肿瘤指数CEA呈线性增加,建议重新检测患者的血液,看是否有耐药基因。突变。如果有突变,可以换成奥希替尼靶向治疗。若无突变,可继续口服吉非替尼靶向治疗,直至出现新病灶或原病灶扩大,可重新穿刺病理进行耐药基因检测。改变治疗计划。
部分阻力
靶向药物治疗后,肺部病变明显缩小,咳嗽、咳痰等症状也有所缓解。然而,此时CT扫描中出现了新的病灶,例如脑转移和骨转移。这种情况一般是由肿瘤的异质性决定的,有的肿瘤有效,有的肿瘤耐药。在这种情况下,建议继续口服靶向药物,因为这种靶向药物对某一部位有效,而且对于新出现的病灶如果可以穿刺,组织可以重新进行病理和基因检测。但如果转移部位不适合再次穿刺和病理,如脑转移、骨转移等,可对新出现的转移灶进行局部放疗,以达到控制的目的。
综合耐药性
本例患者原发灶和转移灶均出现肿大肿瘤,肿瘤指标升高,患者症状明显较之前恶化,同时出现新的转移灶。这时候就意味着靶向药物已经完全耐药了。需要重新穿刺组织进行病理和基因检测,以确定耐药基因。如果患者拒绝穿刺或肺癌患者一般不能耐受穿刺,可以抽血进行基因检测。
综上所述,针对靶向药物治疗后的耐药性,必须做基因检测,经济能力允许的情况下还需要进行NGS检测。
NGS的巨大价值
对于靶向药物耐药的肿瘤,NGS至少会给患者带来以下信息。
1、跨肿瘤类型的靶向治疗的可能性。这是基于“篮子测试”理论的判断,即如果有相同的突变,无论是哪种肿瘤,药物都会起到相似的作用(相同的疾病,相同的治疗),但由于组织不同而器官,其组织结构、功能及其微环境也有很大差异。即使同一位点存在变异基因,对药物的反应也可能有很大差异。因此,各种临床试验数据仍是用药的主要依据。此外,根据基因检测结果,同一组织病理学诊断的肿瘤可以根据基因变异谱分为不同的亚型,并根据亚型进行特异性和个体化给药,也就是说,肿瘤可以有不同的治疗方法。治疗计划(相同的疾病不同的治疗)。
2、免疫治疗药物判断。虽然目前还没有明确的免疫治疗生物标志物,但大规模检测至少可以了解TMB、MSI、DNA损伤修复途径及其相关伴随突变对免疫治疗的影响(包括获益、超进展等)。

3、了解基因组功能对现有常规治疗方案(主要是化疗)的影响。尽管目前所有的基因检测报告都检测到与化疗药物敏感性相关的基因中的单核苷酸多态性(SNP),但这些仅涉及参与化疗药物代谢的酶的活性;通路的改变会很大程度上影响化疗药物的作用,包括肿瘤抑制基因的共失活、表观遗传学、氧化应激、蛋白质降解,以及其他信号网络的改变,如鳞状细胞癌中的TP53、高频RB1共失活导致铂类化疗耐药等。当然,NGS对化疗的指导意义绝不能像靶向一样是一对一的关系,
4、耐药性克隆的富集和进化初步判断。例如,如果“癌干细胞”信号通路、WNT和信号通路过度激活,在治疗过程中,“癌干细胞”将不断富集,成为耐药复发的种子。因为目前的化疗等方法还是比较难杀死这些细胞!
5、通过对上述信号网络的综合分析,或许可以发现癌细胞的薄弱环节,为联合靶向、靶向联合化疗、化疗联合免疫、靶向联合免疫等联合治疗奠定基础。可以尽可能提供。延长耐药性的到来,实现慢性病管理。
当然,对于某些肿瘤类型,例如肺癌,可以在整个治疗过程中进行检测,以帮助调整计划。但是,这些只有在了解NGS报告的基础上才能实现。一些癌症,如高危三阴性乳腺癌(TNBC),由于驱动基因极其分散,需要做WES检测。痕迹。
本文由今日中国医学论坛肿瘤网联合肺癌康复界、东东癌界、邱立新博士共同编译
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话