欢迎光临吉康旅!
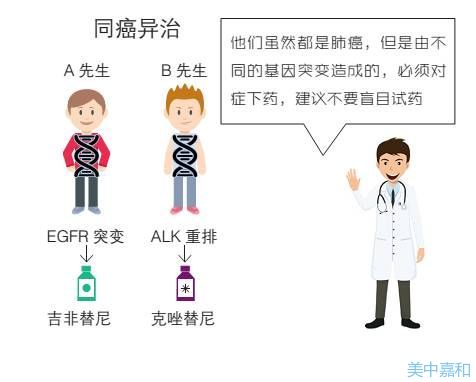
靶向治疗新进展 呼吸内科 阴气精准医学( )是基于个体化医疗,基因组测序技术快速进步,生物信息学与大数据科学交叉应用的一种新的医疗理念和医疗模式。其本质是通过基因组学、蛋白质组学等组学技术和尖端医学技术,对大样本人群和特定疾病类型的生物标志物进行分析、识别、验证和应用,从而准确找到病因和治疗目标。 . ,对疾病的不同状态和过程进行准确分类,最终达到对疾病和特定患者进行个体化、精准化治疗的目的,提高疾病诊断、治疗和预防的效益。该研究开启了肺癌精准医学的里程碑。基因引导精准医疗可延长肺癌患者的 OS。肺癌精准医疗=精准诊断+靶向治疗。 常见驱动基因:EGFR、KRAS、EML4-ALK、ROS1、C-Met等;驱动基因存在于80%的肺腺癌中,而EGFR仍然是亚洲腺癌中最常见的驱动基因,约占50%,高加索人EGFR突变率为10%-20%。 NCI 肺鳞状细胞癌研究的背景:在大量连续的肺鳞状细胞癌患者队列中同时评估了 NGS 用于临床研究分组的可行性和潜在治疗靶向变异的发生率,以及结果用于指导临床实践。治疗。
方法:多中心招募肺鳞状细胞癌患者;根据 IRB 批准的方案获得活检样本;测序:对>300个感兴趣的基因组靶点进行NGS含量测定,覆盖35个基因的内含子,免疫组化鉴定特异性蛋白异常;从所有肺鳞状细胞癌患者中收集临床和 NGS 数据,以评估检测方法的使用、检测失败率和基因组变异的检测。 NCI 研究方法 肺癌靶向药物 EGFR 抑制剂 其他靶向抑制剂 肺癌免疫治疗 EGFR-TKI 靶向药物 代表性药物 靶点突变概率 第一代易瑞沙(吉非替尼) 特罗凯(厄洛替尼) Ni)康马纳(埃克替尼) 外显子 19 点缺失 外显子 21 突变 亚洲人群 30~50% 女性 61.1%,从不吸烟 60.7% 男性 44%,有吸烟史43.2% 第二代阿法替尼()表皮生长因子受体(EGFR )、人表皮受体2(HER2)酪氨酸激酶——双不可逆第三代()(C0-1686)获得性耐药——肺癌患者基因突变2/3表皮生长因子受体( EGFR+) 与含铂双药化疗相比,EGFR-TKI 一线给药对晚期 EGFR 突变患者显着延长 PFS 并显着提高 ORR。
与外显子 21 点突变的患者相比,外显子 19 缺失的患者使用 EGFR-TKI 进行一线治疗可能获得更长的 PFS。对于外显子 18-21 的罕见突变,具有单一罕见突变的患者也可以从 EGFR-TKI 中受益,但不如经典突变那么多。 (阿法替尼复合突变) - 肺 8 研究中 OS 的初步分析(N=795)结论:与厄洛替尼相比,阿法替尼显着降低死亡和疾病进展的风险 19%。阿法替尼阿法替尼显示出比厄洛替尼显着的益处在所有研究终点和亚组分析中,提示阿法替尼可以作为鳞状细胞癌患者二线 TKI 治疗的一个选择。 第一代 VS 第二代结果:与吉非替尼相比,阿法替尼显着提高了 PFS,ORR 更高结果:对 EGFR 突变外显子 19 缺失的患者疗效更好。(是...) 第三代 EGFR-TKI 液体活检 PK 组织活检 I/II 期研究的疗效和安全性,晚期接受治疗的患者EGFR突变耐药后阶段;以组织学检测为标准,血浆突变检测灵敏度为80.9%(313/387),尿突变检测灵敏度为81.@ > 1% (142/171.0@>;三种方法中的阴性个体不完全重叠,提示三种检测方法可以互补,最好结合两种甚至三种方法。
组织活检VS液体活检组织活检液体活检具有肿瘤细胞含量高、无创、易于直接从局部肿瘤信息中获取标本、易于重复采集、方法学要求低、动态检测、临床应用好等优点基础 困难 敏感性 低重复活检 方法学要求高 组织受限 解释 注释 异质性 疑难肿瘤 EGFR-TKI 价格较高 耐药++的患者疗效非常好;研究表明体液检测是可行的; LUX-是迄今为止最大的二线治疗晚期鳞状细胞癌的III期临床研究,结果显示明显低于厄洛替尼。降低死亡和疾病的风险。 ALK-TKI 第 1 代:第 2 代:,第 3 代:后续 ALK 抑制剂开发 ALK 抑制剂治疗治疗失败 ALK+ 疗效和安全性在其他 PFS 研究中对治疗耐药性 ALK+ 患者以及之前未接受过克唑替尼治疗的晚期或转移性 ALK+ 患者的疗效;初治 ALK+ 患者的疗效和疗效 J-ALEX 研究在中期分析中,PFS(10-11m)达到预期预期,而 PFS 的主要研究终点(目前为 20m)未达到。此外,在脑转移瘤的治疗中,ALK抑制剂可以降低脑转移瘤疾病进展的风险。进展总结 克唑替尼 仍然是晚期 ALK+ 的一线一线治疗药物,包括亚裔和脑转移患者;一线ALK+患者疗效更佳;第一代ALK抑制剂耐药后,仍有50%以上的近期反应率,尤其是第三代,对继发耐药靶点的抑制更广,穿透血脑屏障的能力更强.
ALK抑制剂进展总结ALK TKI耐药后,大部分仍依赖ALK通路。 ALK 途径仍然非常重要。整个治疗过程中的第一个治疗是治疗ALK TKI;不同ALK TKI的耐药突变谱是不同的。耐药突变和克隆在治疗过程中动态演变。重复活检是非常必要的。结合分子检测,准确了解耐药机制和动态演变,指导精准治疗策略,克服耐药性。未来,基于耐药机制,ALK TKIs的适当序贯治疗很重要。其他靶向抑制剂BRAF抑制剂达拉非尼(D)联合MEK抑制剂曲美替尼(T)治疗转移性BRAF突变II期研究()达拉非尼抑制BRAF V600激酶和曲美替尼下游MEK信号通路抑制结果:与达拉非尼单药治疗相比BRAF突变,二药联合组抗肿瘤活性ORR更高,二药联合组安全可控。 (后续研究)治疗Ret重排晚期肺癌的II期临床研究Ret重排基因在肺癌研究设计中Ret重排肺腺癌患者的疗效PFS此外,在研究中,117名EGFR患者入组野生型EGFR野生型二线和三线治疗的厄洛替尼与厄洛替尼相比,结果表明厄洛替尼联合厄洛替尼提高了PFS,并在OS方面表现出优势。
克唑替尼治疗晚期ROS1重排ACSe的II期研究初步结果发生在不吸烟的年轻肺腺癌患者中; ROS1和其他突变不会同时存在于人的肿瘤组织中;在FISH筛选的大量组织标本中,ROS重排占1.7%。 ROS1阳性腺癌的组织学分级较高。疗效和生存数据 C-METC-MET 原癌基因属于 PTKs(蛋白酪氨酸激酶)家族的 Ron 亚家族,编码各种形式的 c-met 蛋白 MET 激活,包括 MET 基因扩增、MET 蛋白过表达和 MET基因突变。 2014 年 TCGA 对肺腺癌的基因组学研究发现,MET 扩增是 1.2@>2% 的腺癌的关键驱动基因。 C-METC-MET 过表达的诊断 C-MET 阳性是在接受 MET 抑制剂治疗的 MET 外显子突变肺腺癌患者中,超过 50% 对克唑替尼治疗有反应的肿瘤细胞出现高强度染色。生存期与基线比较 其他靶点优化治疗反应的研究进展总结 达拉非尼联合曲美替尼在 BRAF 突变患者中表现出比单独达拉非尼更高的客观反应率,并且安全性可控;用于肺腺癌患者的 RET 重排疗效; ACSe II期研究进一步证实了克唑替尼对ROS1+的疗效;克唑替尼对MET点突变、过表达和扩增的患者有效。

免疫治疗研究进展 Anti-CTLA-4通路:,anti-PD-1/PD-L1通路:,; I)/二线治疗IIIB/IV期;抗PD-1联合靶向治疗:厄洛替尼联合治疗EGFR突变患者疗效I期研究(部分厄洛替尼获得性耐药患者可达到PR,且反应持续) 联合化疗:联合卡铂+紫杉醇(任何组织学)/培美曲塞(非鳞状细胞,无 EGFR/ALK 突变)在未接受过治疗的 IIIB/IV 期患者中(研究显示联合治疗具有良好的 ORR)免疫治疗进展总结抗 CTLA-1.3@>抗-PD-1/PD-L1对治疗有很好的反应,可以延缓肿瘤生长,延长生存期;如何找到有效的来预测疗效是最大的挑战;早期肿瘤新辅助免疫治疗、无应答者免疫状态特点、联合治疗等尚需进一步研究感谢收听肺癌数据最新进展-靶向治疗篇疗效/安全性和耐受性第一晚期研究中一线治疗,结果显示+患者的PFS明显优于化疗组,而无突变化疗组的PFS优于G组。对治疗状态的深刻理解。
对未来靶向药物的研发和临床研究的设计有着重要的影响。 EGFR表皮生长因子受体用于细胞增殖和信号转导,与配体结合形成同源或异源二聚体,激活细胞内酪氨酸激酶活性,启动下游细胞信号转导,主要在腺癌、腺癌、鳞状细胞癌、大细胞癌、而鳞状细胞癌的突变率很低。 28个外显子,3个突变:外显子19 del,外显子20插入突变(对EGFR-TKI继发耐药)和11.4@>21外显子替代突变 Kras是Ras家族的成员,是EGFR中重要的下游调控基因信号通路中,Kras基因突变可自动激活无EGFR信号通路,启动下游信号转导,使EGFR-TKI进展,对EGFR-TKI无效,EGFR-TKI主要见于肺腺癌,预后较差。 EML4和ALK这两个基因分别位于人类2号染色体的P21和P23上,通过倒位融合形成融合基因,表达新的融合蛋白。正常人群中没有这种融合基因。常见于既往很少或无吸烟史、年轻患者、其他肺腺癌常见病理类型与EGFR基因突变互斥,这也是EGFR-TKI耐药的另一个原因。表达或基因突变可导致ROS1蛋白失调。 ROS1融合基因阳性的患者PFS较短,术后切除后需要更积极的辅助治疗和复发监测。与 ALK 阳性相似,小/不吸烟和年轻腺癌患者常见。
与酪氨酸激酶区ALK基因的同源性可达49%,激酶催化区的ATP结合位点同源性为77%,因此ALK抑制剂是有效的。 2014 年 6 月,美国国家癌症研究所 (NCI) 与西南肿瘤学组 (SWOG)、多家私人基金会和 5 家制药公司共同启动了一项针对生物标志物驱动的鳞状细胞肺癌药物的前瞻性研究。成纤维细胞生长因子受体细胞周期蛋白依赖性激酶CDK细胞周期蛋白罕见突变:19和21以外的突变。第一项比较TKI药物治疗晚期肺鳞状细胞癌疗效的研究。接受化疗后病情进展,此前未接受过EGFR-YKI药物治疗。全球首例头对头二代VS一代,一线治疗EGFR突变阳性晚期疗效及安全性。研究表明,在AURA研究(第一代EGFR-TKI治疗I期进展后的剂量递增研究)中,不同剂量对阳性患者均有良好的抑制和治疗作用。总体 ORR 达到 59%,最高 ORR 出现在 80 mg。达到 66%。对阴性患者也有很好的治疗效果。 (FDA迅速批准该药用于治疗阳性患者)-X研究,由于其疗效稳定性差,中毒作用更严重(高血糖)FDA尚未批准液体活检与组织活检上市,靶向TKI-,- X是基于分子检测技术确定突变状态,进而指导药物选择,虽然研究结果表明R没有表现出足够的临床效用,但该药物遗憾地离开了市场。

但是侧面已经证明,基因检测、血液甚至尿液检测样本的灵敏度商都可以与传统的组织样本相媲美。该试验获得了 548 例 EGFR 阳性患者的安全性数据,其中 443 例具有 R 疗效数据。其中,540 人完成了组织检测,482 人保留了血液样本,213 人保留了尿液样本。 J-ALEX研究目前是第二次合理安排出场顺序。多个 ALK-TKI 完成了 ALK+ 的完美接力。 BRAF 是一种鸟苷酸结合蛋白 RAS 激活的丝氨酸/苏氨酸蛋白激酶,它调节丝裂原活化蛋白激酶 (MAPK) 信号通路,BRAF V600 突变体的产生显着增强了 BRAF 活性,导致癌细胞分裂研究已被批准用于晚期转移性甲状腺髓样癌 此外,ROS1 编码受体酪氨酸激酶 (RTK),与细胞生长/增殖/分化/存活有关 C-MET 原癌基因属于 PTKs(蛋白酪氨酸激酶)家族的 Ron 亚家族,编码c-met蛋白MET具有多种激活形式,包括MET基因扩增、MET蛋白过表达和MET基因突变。 2014 年 TCGA 对肺腺癌的基因组学研究发现,MET 扩增是 1.2@>2% 的腺癌的关键驱动基因。会议报道,约33%的(MET/ALK/ROS1靶向抑制剂)患者获得了编码MET的关键负调控区,该调控区参与MET蛋白的泛素化和降解。
删除此结构可提高满足稳定性并导致下游信号持续激活。 Met 外显子 14 在转录水平被跳过。会议报道,约33%的克唑替尼(MET/ALK/ROS1靶向抑制剂)患者获得人源化抗CTLA-4 IgG1单克隆抗体。人源化抗 CTLA-4 IgG2 单克隆抗体人源抗 PD-mAb。 017 IIId vs. 多西他赛作为肺鳞状细胞癌的二线治疗,由于中期分析显示 N 组的 OS(中位 OS1.6@>2m)显着高于化疗组(6m),该研究还评估了PD-L1的表达,发现PDL1不是预后和疗效预测因子。 057 III期,582例一线含铂双药化疗失败的非鳞状肺癌患者随机分配至多西他赛组,研究提前终止。在化疗组(1.6@>4m),PDL-1表达的标志物分析与疗效提高相关,表明它在非鳞状肺癌(人源化抗pd-抗体)中也具有生存优势。研究, 287 随机 PD-L1 高表达的患者受益于接受多西他赛治疗。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话