欢迎光临吉康旅!
一、2020年国内新药数据回顾
1、国内新药首次获批突破10个
2020年,国内新药获批数量达到11个,首次达到两位数。其中,肿瘤新药6个,麻醉新药2个,丙肝新药3个。
(此处已添加圈卡,请到今日头条客户端查看)
2、国内新药报告数首次突破20个
2020年已有20多个国内创新药提交上市申请,预计2021年国内新药获批数量将继续超过两位数。
3、国内新药IND首次突破300
2020年,国产新药新IND达386个,首次突破300个。国内CRO和CMO业务有望继续蓬勃发展。
二、2021年行业展望
1、展望一:未来3年,每年将有10-20个国产新药获批
随着我国创新药产业的崛起,自2013年以来,国内新药临床申请量逐年增加,近几年进入持续爆发阶段。 2019年国内IND达到235个,2020年11月达到358个。 2018-2020年,每年有近10个国产新药获批上市,主要来自2013-2015年的IND品种。
随着近几年IND数量的爆发式增长,预计未来三年国内每年获批的新药数量有望进一步增加,达到10-20个的水平。
p>
2、前景二:批量上市成为常态
2018年以来,随着大量未盈利的生物科技公司在港交所/科创板上市,已有30多家在A股和港股上市交易。 2020年有18家首次或二次上市。
预计未来5年上市的创新药企有望扩大到100家左右,再加上部分传统药企有望实现创新升级转型,创新药上市目标将不断丰富,带来更多投资机会。
目前,顶级公司的市值已经达到1000亿,而尾部公司的市值只有2-30亿。市场已经开始押注未来可以成长为平台型,并以此作为定价的关键因素,公司差异化将成为常态。
在这种定价逻辑下,同一品种对每个公司的估值水平也会有所差异。与美股类似,小微公司未来市值可能会出现一匹黑马。

3、前景三:国际化趋势确立
2020年12月,LCAR-B38M和索凡替尼均开始在美国提交上市申请。普那布林、恩沙替尼、贝格司亭三款国产新药均已完成注册研究,预计将于近期在美国提交上市申请。
预计2021年,康柏西普以及多款国产PD-1 mAb将在美国完成III期临床试验。
过去,FDA批准的国产新药数量很少,只有LCAR-B38M、等少数几个品种。 2020年,10余款国产新药获得了多项FDA认证。
在过去的几年里,有多个国内新药被授权给海外公司。其中,传奇生物的BCMA-CAR-T产品LCAR-B38M和天景生物的CD47单克隆抗体获得了大笔首付。
4、前景四:传统药企转型层出不穷
5、展望5:替尼不爆,抗体先成红海
2020年将验证小分子领域的许多新机制和新靶点:
KRAS通路:曾经“不成药”的靶点KRAS已完成临床验证,安进已提交KRAS-G12C抑制剂上市申请; SOS1、SHP2等相关通路靶点药物陆续进入临床。
变构抑制剂:新的小分子技术,可解决耐药性问题并调节非药物靶点和蛋白质相互作用。诺华ABL1变构抑制剂较博舒替尼治疗CML成功取得III期优势;多种SHP2变构抑制剂已进入临床。
:是一种诱导蛋白质降解的通用平台技术。一端靶向靶蛋白,另一端结合泛素连接酶E3,使靶蛋白与E3连接酶结合降解。 2020年12月,公司发布的候选药物ARV-471(雌激素受体降解剂)更新,数据显示潜力最佳,市场价值大幅提升。
小分子进入自身免疫领域:自身免疫作为抗体最大的应用市场,已经达到百亿级别,并被TNFα、IL17/23等生物制剂占据。近年来,JAKi等小分子在一些适应症中被证明具有更好的疗效和依从性,有望开始蚕食大分子的市场份额。
过去5年,国内生物科技呈现爆发式发展趋势,“生物药是朝阳产业,化学药是明日之花”的观点占据主流。
6、展望六:免疫双抗有望成为下一阶段的重点
7、展望七:国内企业大规模并购仍难发生
大多数制药公司的现金储备有限。稀释的意愿是有限的。
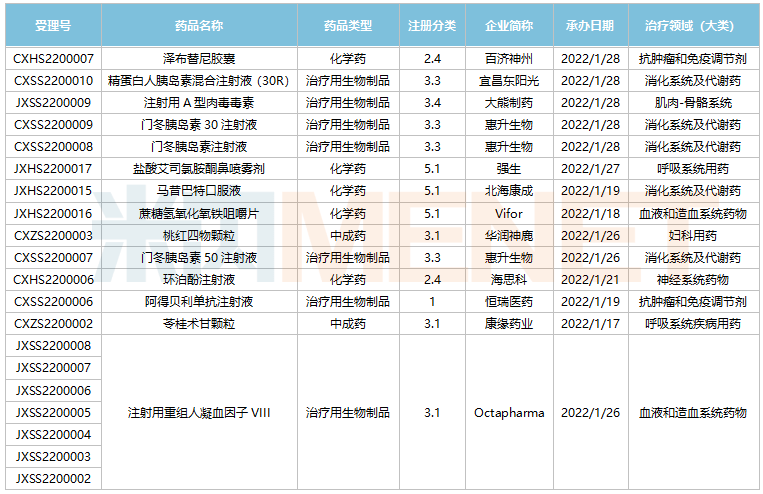
2019-2020年,国内药企合作较多,均为代理销售、合资、研发合作,合作量较小。思考:现阶段,这是国内药企创新药合作较为务实的选择。
8、展望八:医保谈判常态化
回顾过去5轮创新药医保谈判,降价是主旋律,明显平均降幅在40-60%之间(不考虑捐赠药品)。叠加采购政策,仿制药设备降价90%以上,市场和行业都对创新药的未来感到担忧。
一方面,我们可以看到国内创新药产业的明显崛起。我们每年可以批准10-20个国内创新药,数量上可以与美国相媲美,甚至可以在一些前沿目标领域超越欧美,并将技术出口到海外许可。而医药巨头则担心政策的意外压力会动摇行业的长期商业模式。
其实从这几年的结果来看,医保局的降价标准一直保持在比较合理的范围内
从新药销售额来看,虽然谈判的医保品种下降了60%,但除部分专利已过期的产品外,大部分创新药实现了量价比价,进入医保后,金额迅速变现。大幅增长。
似乎可以得出一个与“动辄降价打压行业”截然相反的结论,医保局其实一直在“鼓励行业”。
虽然创新药和医保的谈判明朗,但市场仍担心反复谈判会打压新药的长期商业价值。从底线价格来看,如果一种新药的价格低至自费使用人群的50%,自费使用的经济负担较小,动机而药企降价的可能性将接近0。例如:假设未来PD-1单抗年化成本降到2万元,按照平均半年使用时间,患者只需支付1万元不报医保。
三、总结
2020年医药板块投资机会解读将主要围绕疫情影响和赛道龙头展开。由于相关度较低,创新药以公司内部逻辑为主,投资略显清淡。不过,展望2021年,我们认为创新药板块“有性价比、有看点、有弹性”,具备成为下一阶段板块主攻方向的条件。
3 条主线:
1、恒瑞药业:迈向全球一流药企
恒瑞医药的研发管线基本实现了对创新药热点靶点的全面布局。 2018年以来,密集的审批工作开始了,进入了十年新药研发的收获季节。随着硫培非格司亭、吡咯替尼、卡瑞利珠单抗、氟唑帕尼、海曲波帕等多个重磅产品的陆续上市/获批,创新药成为公司业绩增长的核心驱动力,推动公司不断向全球第一迈进一线制药公司。
2、贝达药业:引领小分子,走向国际化
10余个在研新药进入临床后阶段,其中2个上市产品埃克替尼和恩沙替尼,术后辅助埃克替尼、贝伐单抗、沃罗尼等5个适应症EGFR+二线、恩沙替尼一线进入审批阶段( NDA/BLA/pre-NDA)。
同时公司早期产品包括CDK4/6、长效GLP-1、/2/3、BET、MER/FLT3、ERK1/2、、2nd TRK、EGFR//、等产品已陆续进入临床I期。
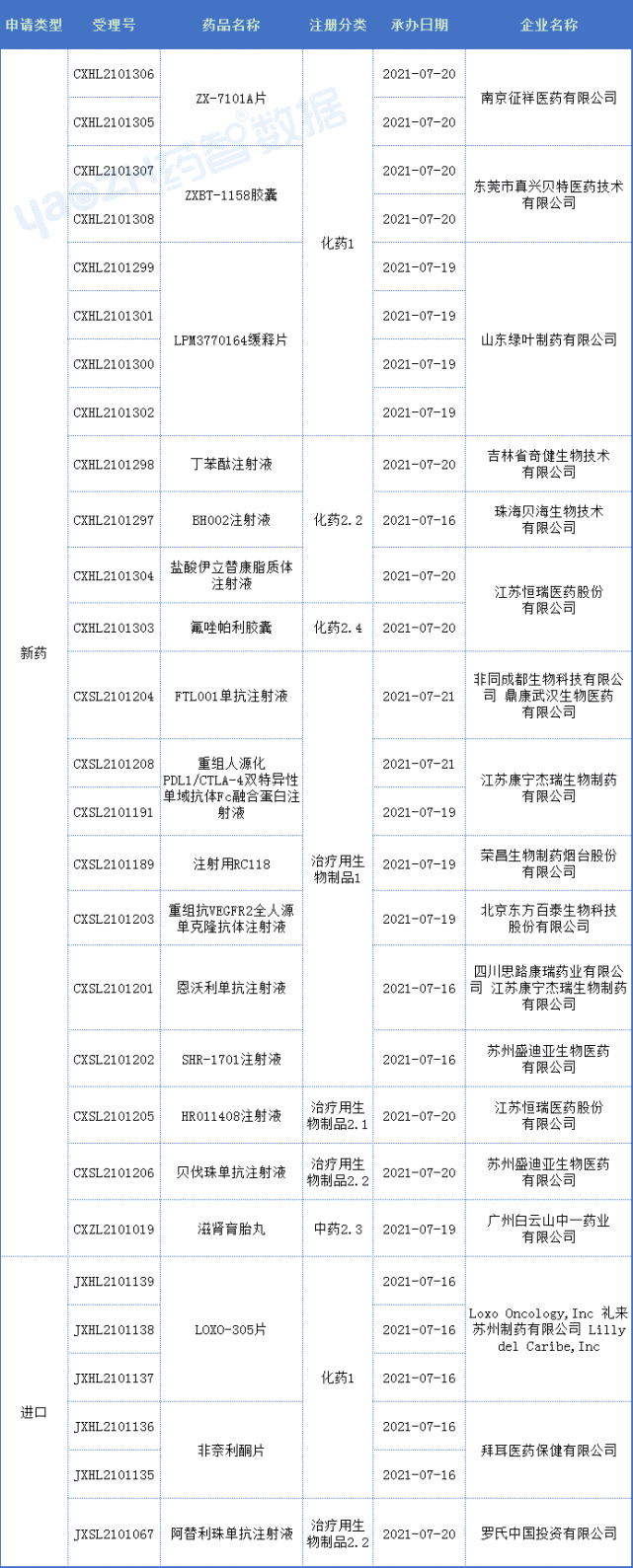
3、 Bio:免疫领导者,持续引进合作
信达生物在肿瘤免疫方面实现深度领先布局,PD-1、CTLA-4、OX40、LAG-3、、CD47等靶点在国内市场处于领先地位,拥有多款双抗体产品进入临床阶段。未来有望成为国内肿瘤免疫的领导者。
2020年上半年,信迪利单抗销售额9.2亿元,展现了公司卓越的商业化能力。
4、康方生物:双抗体龙头,自主研发实力雄厚
公司拥有丰富的创新药物产品管线,用于治疗肿瘤、自身免疫、炎症、代谢疾病等重大疾病,均来源于自主研发。
PD-1单克隆抗体已提交上市申请,预计2021年获批; PD-1/CTLA-4双抗体正在注册研究中,预计2021年生产;默克海外授权CTLA-4单克隆抗体已进入临床III期。
5、君实生物:PD-1纳入医保,中和抗体有望超预期
公司拥有国内首个商业化PD-1 mAb,销售正处于快速增长期。
公司授权礼来公司的新冠中和抗体有望在2021年获批紧急用于治疗轻症新冠患者。考虑到欧美患者人数众多,市场空间巨大。
6、亚盛医药:细胞凋亡的领导者,Bcl-2有望分享全球市场
亚盛医药致力于肿瘤、乙肝和衰老相关疾病领域的新药研发。公司拥有自建的蛋白-蛋白相互作用靶向药物设计平台,在细胞凋亡通路新药研发方面处于世界领先地位。前沿。公司拥有多条进入临床开发阶段的1类小分子新药产品管线,已在中国、美国、澳大利亚进行了40余项I/II期临床试验,4个在研新药取得获得8项FDA孤儿药资格。治疗耐药性慢性粒细胞白血病的核心品种已在中国提交新药上市申请,并获得美国FDA审查快速通道和孤儿药认证。
APG-2575是全球第二个进入临床的Bcl-2抑制剂。复发/难治性CLL临床研究结果显示,可评价患者单药ORR达到70%,未观察到实验。预计在患有心室或临床肿瘤溶解综合征 (TLS) 的患者中,剂量递增的安全性会更好。未来,APG-2575有望在全球CLL、AML、WM市场获得相应份额,成为重磅产品。
7、荣昌生物:原研药多,国际化可期
公司拥有RC48,中国首个上市的HER-2 ADC产品,已报告生产胃癌和尿路上皮癌2个适应症。
用于治疗系统性红斑狼疮的已在中国提交上市申请,并在美国获批临床应用。未来有望国际化,市场空间巨大。
8、和黄医药:解决未满足临床需求的国际定位
和黄医药科技有限公司是一家立足中国、面向全球的小分子创新制药公司。公司拥有约550人的研发团队,专注于治疗癌症和免疫疾病的靶向创新药物的研发和商业开发。目前,多个抗肿瘤药物已进入临床阶段,世界各地都在开展临床研究。
首个新药呋喹替尼在中国获批上市,索凡替尼和萨瓦替尼均已提交中国上市申请。索凡替尼于2020年12月29日在美国启动滚动上市申请,公司正式进入国际化阶段。萨瓦替尼与奥希替尼的联合用药也在美国进行注册研究,未来有望实现国际化。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话