欢迎光临吉康旅!
记者 |郑洁
编辑 |谢欣
3月20日,君实生物宣布其用于鼻咽癌适应症的PD-1特瑞普利单抗正式上市,并发布了特瑞普利单抗联合贝伐单抗用于晚期肝细胞癌一线治疗的II期研究初步分析结果并启动一项国际多中心 III 期临床研究 (-10,)。
3 月 21 日,礼来(Eli )和信达()联合宣布推出其 PD-1 注射液的新适应症,用于一线治疗非鳞状非小细胞肺癌。
自2018年12月17日国内首个PD-1特瑞普利单抗上市以来,PD-1赛道越来越拥挤。据西南证券统计,目前中国是PD-1研发最火热的地区。全球154个PD-1中,有85个是中国企业研发或联合研发的,占比55%。 -1 mAb 将达到 15。
在这种情况下,如何把钱花在PD-1的研发和推广上,实现商业利益最大化,就成了每个企业的重中之重。原研外企率先采用“降价”配方,不仅降价,2020年医保后,更针对更多免费药品推出“变相降价”计划。
2020年12月28日,默克公司宣布,自2020年1月1日起,对于首次接受派姆单抗治疗的患者,将维持原“买2送2”的捐赠计划,后续捐赠将延长至“ 2+N”,但患者累计使用不超过24个月。与前两年57万元的成本相比,降价率达到75%。同样,百时美施贵宝也增加了捐赠药物的数量,纳武单抗也由原来的“前3+3,后3+4周期”调整为每年的“3+3,后3+X”。新计划下,患者年自付费用比挂牌价降低75%以上。
对于原本价格低廉的国产PD-1,一方面希望扩大适应症,另一方面也在大力推动产品出海。
其中,信迪利单抗已获批用于复发或难治性经典霍奇金淋巴瘤和非鳞状非小细胞肺癌的适应症。信替利单抗还有3个新适应症申请(“sNDA”)已获NMPA受理审评,即信替利单抗联合吉西他滨和铂类化疗一线治疗鳞状非小细胞癌的新适应症细胞肺癌 信替利单抗在鳞状非小细胞肺癌二线治疗中的新适应症申请,以及信达自有贝伐单抗治疗肝癌一线患者的新适应症申请。
君实生物发布了特瑞普利单抗联合贝伐单抗一线治疗晚期肝细胞癌Ⅱ期的单臂、多中心、开放标签临床研究,旨在将下一个适应症扩大到大适应症肝癌。目前的结果表明,特瑞普利单抗联合贝伐单抗的客观缓解率为47.7%,高于国际上已报道的大多数晚期肝癌治疗方案。同日,君实生物宣布启动特瑞普利单抗联合贝伐单抗一线治疗晚期肝细胞癌的III期临床研究。
在适应症方面,国内PD-1已开始就肺癌、肝癌等核心适应症的竞争展开直接对话。
除了扩大适应症,君实生物还选择与国外药企合作。今年2月28日,君实生物宣布授予阿斯利康在中国大陆非核心市场推广特瑞普利单抗的权利,以及后续获批的尿路上皮癌适应症的独家推广权。
2020年8月,信达生物与礼来宣布扩大战略合作,信达生物将授予礼来在中国以外的独家许可,此前2月1日,君实生物宣布达成合作参与 在美国和加拿大的开发和商业化,百济神州也将其 PD-1 的海外权利授权给了诺华。
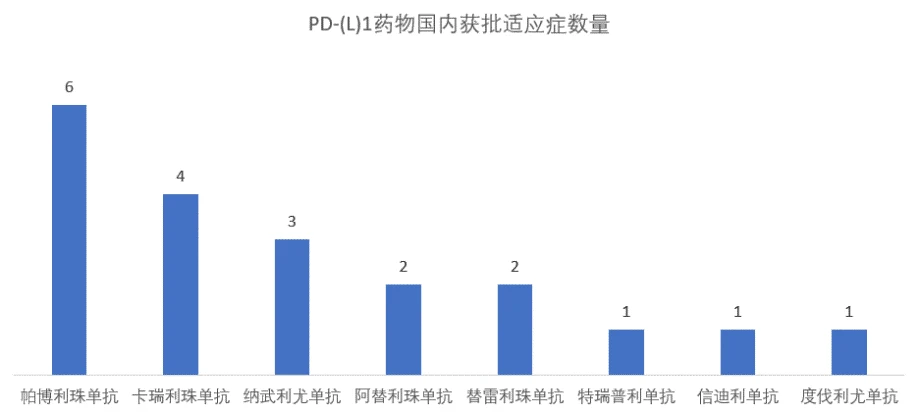
目前,国内目前有6款PD-1上市,其中4款国产PD-1已纳入国际医保,更多PD-1已经在路上等待入场,无论是是降价、捐药,还是出海,加大适应症,虽然PD-1的“千亿市场”很大,但目前来看,商业化之路并不平坦。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话