欢迎光临吉康旅!
在开始文章之前做一个小调查
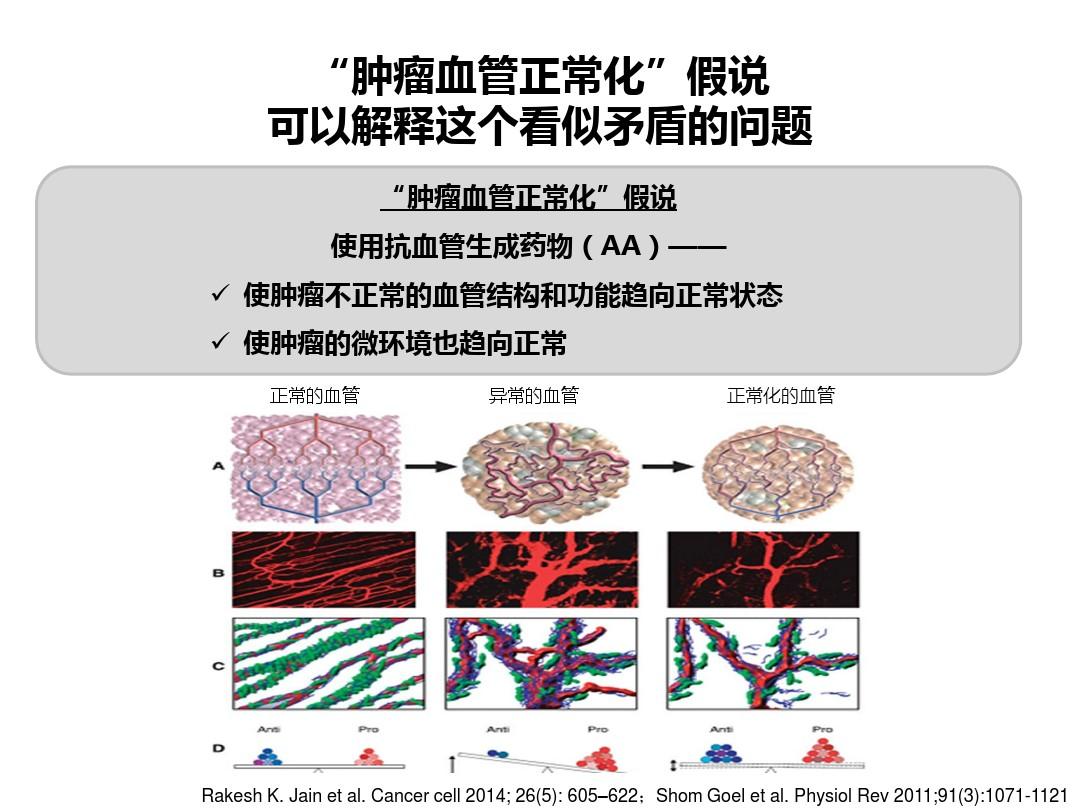
无论指南、说明或医疗保险政策要求如何,建议将安罗替尼和阿帕替尼用于癌症的三线治疗,然后
近两年,笔者发现,临床上,我真的很喜欢使用小分子抗血管生成药物超出说明书。
小分子抗血管生成药物一般推荐用于二线和二线治疗,例如根据指南、药物说明书和国家医保目录:安罗替尼获批用于晚期肺癌的三线治疗,以及阿帕替尼被批准用于晚期胃癌。瑞戈非尼被批准用于晚期结直肠癌的三线治疗。换句话说,这些小分子抗血管生成药物在没有治疗的情况下是最后的选择。
然而,在临床实践中,许多肿瘤学家在实施晚期肿瘤(PD-1/靶向药物/化疗)的一线/二线治疗方案时,喜欢加入小分子抗血管生成药物以提高疗效。
笔者推测,可能是因为贝伐珠单抗联合化疗在肺癌治疗中的巨大成功以及众多肿瘤学家的持续广泛宣传。这是正确的。但不知道大家有没有想过一个问题:2021年,全球新增乳腺癌221万例,肺癌220万例。乳腺癌的发病率已超过肺癌,成为发病率最高的肿瘤。这么大的市场,为什么没有针对肿瘤的抗血管生成药物?
事实是,贝伐单抗早在十多年前就开始挑战晚期乳腺癌的一线治疗。早在2008年,贝伐单抗甚至已经获得了FDA的快速批准,但在2010年,贝伐单抗终于获得了FDA的批准。反滑铁卢遭遇严重滑铁卢,因为当时贝伐珠单抗注射液(商品名:安伐他汀)在国内还没有上市,国内能用贝伐珠单抗的患者数量非常少,而且年代久远,大家都是很少提及,所以现在知道真相的人很少。从事临床研究的工作人员都非常清楚这次失败,让后来市场上的抗血管生成药物失去了蚕食这块大蛋糕的欲望。
今天我们就来回顾一下贝伐珠单抗治疗乳腺癌的三大临床研究,探讨抗血管生成药物为何难以摆脱“赢得PFS”和“失去OS”的困境。
贝伐单抗在 PFS 中获胜
贝伐单抗治疗晚期乳腺癌的三大临床研究实验设计
2007年,贝伐单抗神采飞扬,临床研究发表在顶级期刊《新英格兰杂志》上。这是一项针对晚期转移性乳腺癌 (MBC) 患者的紫杉醇联合贝伐单抗与紫杉醇的头对头比较研究。
研究表明,紫杉醇联合贝伐珠单抗治疗组患者的PFS几乎是紫杉醇单药组患者的两倍(mPFS 11.8个月VS.5.9个月,P,无看到不良反应显着增加,安全性好,2008年2月,FDA通过快速通道批准通道批准贝伐单抗+紫杉醇用于Her-2阴性晚期转移性乳腺癌患者的一线治疗,未接受化疗。
研究的巨大成功给了后来的研究人员很大的信心。一场春雨后如雨后春笋般涌现的研究报告,有力地支持了贝伐单抗在MBC一线和二线治疗中的地位。例如:
在这些研究中//-1被称为贝伐单抗治疗晚期乳腺癌的三大临床研究。
图:贝伐珠单抗治疗晚期乳腺癌三大临床研究的PFS总结分析(参考1)
三项主要临床研究已将 PFS 列为主要研究终点。对 PFS 结果的总结分析表明,将贝伐珠单抗 PFS 添加到化疗已取得了统计学上的显着获益 [总体 HR 为 0.70(95% CI,0.57 至 0. 8< @6)],相当于将基于贝伐单抗的治疗方案的无病进展风险降低 30%。研究之间观察到统计学显着的异质性(P = 0.000<@6), 2 = 77%。
2010年的突然变化
图:贝伐珠单抗治疗晚期乳腺癌三大临床研究最终结果
图:贝伐珠单抗治疗晚期乳腺癌三大临床研究OS总结分析(参考1)
随着三大临床研究的推进,2010年三大研究的OS结果相继出炉,最终的OS结果令人震惊。三大研究组倒下。巨大的 PFS 优势并没有转化为操作系统优势。OS 汇总结果为 HR 0.95、95% CI、0.85-1.06。
随后,在 2010 年 7 月 20 日的 FDA 药物评价与研究中心肿瘤药物咨询委员会(ODAC)上,FDA 综合了三项临床试验的疗效和安全性数据,-1,发现贝伐单抗只能延长患者的PFS不能提高患者的OS,严重不良反应的发生率增加。在投票环节,贝伐珠单抗联合化疗治疗晚期乳腺癌以12票赞成、1票反对退出。一线治疗获批。
其他一些小分子抗血管生成药物(TKIs)舒尼替尼等晚期乳腺癌临床研究基本以失败告终。联合化疗或其他靶向治疗对生存时间无明显改善,单药总缓解率为11%以下。
弹性增长 ()
乳腺癌抗血管生成治疗一直无法跳出“赢PFS,输OS”的困境,引发了新药研发和临床研究领域的思考。
对抗血管生成药物耐药机制的研究发现,抗血管生成治疗不会延长OS。主要原因是停药后出现“反弹增长()”。经典的证据是发现动物移植肿瘤在使用抗血管生成药物7天后MVD显着降低,但在停药7天后几乎恢复原状。这是由于肿瘤血管的抗血管后退,缺氧环境导致肿瘤内缺氧诱导因子(HIF)上调,激活c-MET-VEGF通路。一旦停止使用抗血管生成药物,失去抑制作用的新血管就会大量形成,导致肿瘤“反弹”。
图:A,未经抗血管生成治疗的肿瘤血管致密;B、抗血管生成治疗7天后,血管开始正常化,血管密度稀疏;C、停止抗血管生成治疗两天后,血管开始快速再生;D、停止抗血管生成治疗7天后,正常血管再次被肿瘤血管替代,密度已恢复到抗血管生成前的水平。(图片来源:参考文献2)
说说“A+T”之争
图:NCCN非小细胞肺癌()
事实上,肺癌领域也有赢“PFS”输“OS”的案例。那就是近年来备受争议的“A+T”模式。
尽管厄洛替尼+贝伐珠单抗(A+T)治疗模式获得了EMA的批准,并被NCCN/CSCO指南推荐用于晚期EGFR突变,但这种治疗模式从未获得FDA的批准,我们不禁要问为什么?仔细观察会发现:
“A+T”三大临床研究仅证实了“A+T”模型中PFS的获益,对于OS的显着获益尚无确凿证据。研究的最终结果发现,“A+T”与单药厄洛替尼相当,“A+T”的中位OS甚至低于单药厄洛替尼0.4个月(mOS 4< @7.0 m vs 4<@7.4 m ;HR 0.81; 95% CI, 0.53-1.23; P = 0.326 7)。
不忘过去,指引未来,现在想一想:在“撤回贝伐单抗治疗乳腺癌适应症”的背景下,FDA谨慎搁置“A+T”批准是理所当然的. .
图:PFS (A) 和 OS (B) 的结果(参考 3)
最后的话
在MDT期间,陆顺教授多次指出,我国抗血管生成药物使用过多。作者还认为:
抗血管生成药物在停药后有“反弹增长”,大多数情况下“PFS”不能转化为“OS”效益需要高度警惕。因此,所谓能增强疗效的“PFS”或“ORR”并不是评价抗血管生成药物的良好指标。OS是评价抗血管生成药物疗效的最终标准。
话题互动
用于小分子抗血管生成药物的临床应用
你怎么看?
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话