欢迎光临吉康旅!
患者是一名 67 岁的男性。2018年11月23日,陕西省某三级医院首次确诊为“间歇性咳嗽1个月以上,加重6天”的主要原因。患者主要症状为近一个月间歇性咳嗽,低等级发烧和疲劳; 胸部 CT 显示左肺占位性病变和左侧胸腔积液。有10余年高血压、糖尿病病史,血压、血糖控制良好。患者有长期重度吸烟史,吸烟指数大于400年。入院时体格检查生命体征平稳,左下肺呼吸音减弱,其余体格检查未见明显阳性体征。
图1:首次入院胸部CT(2018/11/23)
入院后辅助检查:男性肿瘤标志物:CEA:19.72 ng/ml,胸腔积液检查发现有渗出液,其中CEA:181.85 ng/ml,胸腔积液中找到肿瘤细胞细胞蜡块。影像学检查:颈部及锁骨上窝淋巴结:右侧颈部及锁骨上窝淋巴结肿大,皮质及髓质不清,最大1.4x1.3 cm,左侧颈部下部及锁骨上窝淋巴结可见,最大1.1x0.5 cm。全身骨扫描、上腹部及肾上腺CT、颅脑磁共振未见明显异常。
入院后,对患者右侧锁骨上窝进行穿刺活检。病理结果:(右锁骨上窝淋巴结)送检为纤维结缔组织,转移性低分化腺癌,免疫组化示肺起源。免疫组织化学:TTF-1(+)、P40(-)、P63(-)、CK7(-)、Syn(-)、CgA(-)、CD56(-)、ki-67 80%。肿瘤68基因NGS:EGFR,突变丰度18.81%。PD-L1 表达水平:PD-L1[28-8]:肿瘤细胞 +5%,PD-L1[]:肿瘤细胞 +45%,PD-L1[]:肿瘤细胞 +65%。
至此患者诊断明确:左下叶恶性肿瘤(腺癌,IVA期,EGFR,PS=0),纵隔淋巴结继发性恶性肿瘤,颈淋巴结继发性恶性肿瘤(双侧),肺继发性恶性肿瘤) (双肺)继发于胸膜恶性肿瘤(左侧)、恶性胸腔积液;2型糖尿病;高血压3级(非常高风险)。
患者被转诊至我院时,我们建议家属再次取肺部病变进行活检和基因检测,但经会诊,家属拒绝了创伤性较大的活检。所以我们根据外院淋巴结活检和基因检测结果为患者制定了治疗方案。
事实上,对于这样一个Ⅳ期EGFR突变阳性的肺腺癌患者,在一线治疗方案的选择上并没有太多的纠结。我们根据当时CSCO原发性肺癌诊疗指南(2018)口服治疗吉非替尼的I级推荐给患者常规剂量。在吉非替尼一线治疗初期,效果比较明显。服用吉非替尼2个月后,2019年1月患者病灶明显缩小,胸腔积液也较前期减少。效果评价为PR;2019.4 与2019年1月相比,疗效评价为PR;2019年6月与2019年4月对比,疗效评价为SD;2019 年 9 月与 2019 年 6 月相比,
图2:胸部CT(2019/1/24、2019/4/9、2019/6/5、2019/9/3)
至2019年11月25日,患者因发热再次入院。胸部CT显示左下叶软组织密度比以前大,双肺多发结节比以前多,左侧胸腔积液比以前多。此时评估疗效为PD,考虑到吉非替尼耐药的可能性较大,建议患者再次活检并做基因检测。家属也拒绝了创伤性更大的穿刺活检,所以我们对患者进行了血液基因检测(NGS技术,1021基因)。基因检测结果显示EGFR,突变丰度0.6%,同时阳性。基因检测结果告诉我们,EGFR突变的丰度降低,呈阳性。
到2020年2月,患者将在服用奥希替尼2个月后进行疗效评估。胸腔积液较之前有所增加,病情有局部进展。所以为了控制胸腔积液,我们在胸腔内加入了重组人内皮抑素注射液(Endo)局部注射。然而,这样的方案对于病灶控制不是很有效。4月20日,患者复查胸部CT显示两个肺结节较之前增大、增大,胸水控制不佳,病情呈广泛进展。
图3:胸部CT(2020/2/18、2020/4/10)
对于此时应对第三代TKI耐药的对策,根据2020 CSCO非小细胞肺癌诊疗指南,我们向家属推荐含铂双药化疗或联合贝伐珠单抗,但家属患者成员强烈拒绝化疗。那么接下来的治疗方案应该如何调整呢?
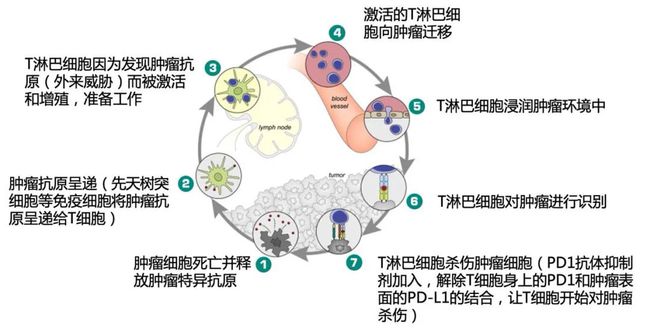
考虑到患者目前阳性,拒绝化疗,我们考虑奥希替尼联合贝伐珠单抗等治疗方案是否可行?我们在查阅文献的过程中发现,一线使用奥希替尼联合贝伐珠单抗可以显着延长患者的中位PFS至19个月,客观缓解率可达80%[1]。这项研究的结果非常乐观,给了我们信心,因此我们决定在奥希替尼的基础上加入贝伐单抗抗血管生成。
使用奥希替尼联合贝伐单抗2个月后,即6月20日,患者肺结节和胸腔积液与之前相比没有变化,治疗效果评价为SD;与8月20日6月20日相比,疗效评价为SD;10月20日与8月20日相比,疗效评价仍为SD。这段时间病人的情况虽然比较稳定,但他的胸部CT显示,胸腔积液和原来的病灶实际上呈缓慢增加的趋势。我们选择奥希替尼联合贝伐珠单抗似乎没有达到预期的效果。
图4:胸部CT(2020/6/4、2020/8/28、2020/10/13)
因此,我们停下来反思目前的治疗方案:奥希替尼联合贝伐珠单抗能否达到1+1>2的效果?巧合的是,这是一本书。此时,20年的ESMO年会上,日本学者展示了他们团队的研究成果。研究发现,对于既往接受过EGFR-TKI治疗且获得性突变的患者,二线使用奥希替尼联合贝伐珠单抗可达到较高的ORR,但联合组的中位PFS(9.4个月)明显小于奥喜单药组(13.5个月)。同时,在奥希替尼联合贝伐珠单抗的患者中,先前接受过抗血管生成药物治疗的患者的中位PFS甚至更短[2]。回到我们的治疗计划,
这个时候我们也给家人推荐过穿刺活检和基因检测,但是家人拒绝了,所以我们用胸水进行了基因检测(NGS技术,1021基因)。事实证明,这项基因检测非常有价值。它告诉我们两个重要的信息。一是患者肿瘤突变负荷高(TMB:15./MB),二是存在-cis突变。顺势突变提示当前患者对第三代EGFR-TKI耐药;高肿瘤突变负荷,加上既往患者的高 PD-L1 表达水平,表明患者可能受益于免疫治疗。那么接下来的问题是,既然现在的患者对第三代TKI耐药,下一步的治疗策略应该如何选择?这个时候应该开始免疫治疗吗?于是我们带着这两个问题进行了文献综述。首先,关于治疗方案,研究表明布加替尼联合西妥昔单抗可取得比化疗更好的疗效,不良反应在可接受范围内[3]。其次,关于免疫治疗,-870研究表明,过去接受EGFR-TKI耐药后,EGFR突变状态似乎对的疗效没有显着影响[4],提示既往接受过EGFR-TKI耐药的患者靶向治疗失败可以治疗 被用作后路治疗选择。梳理一下目前的想法:目前对患者的基因检测提示顺式突变,并且肿瘤突变负荷高。有 4 种治疗方案可供选择: 方案 1:西妥昔单抗联合布加替尼;方案二:免疫治疗或免疫联合化疗;选项 3:化疗;选项4:参与临床研究。与患者家属谈及治疗方案的选择,患者家属拒绝进行临床研究和化疗。此外,由于布加替尼尚未在中国上市,暂不考虑方案一。考虑到副作用、药物的可及性和家属的意愿,我们为患者制定的三线治疗方案为纳武单抗,每2周一次。免疫治疗或免疫联合化疗;选项 3:化疗;选项4:参与临床研究。与患者家属谈及治疗方案的选择,患者家属拒绝进行临床研究和化疗。此外,由于布加替尼尚未在中国上市,暂不考虑方案一。考虑到副作用、药物的可及性和家属的意愿,我们为患者制定的三线治疗方案为纳武单抗,每2周一次。免疫治疗或免疫联合化疗;选项 3:化疗;选项4:参与临床研究。与患者家属谈及治疗方案的选择,患者家属拒绝进行临床研究和化疗。此外,由于布加替尼尚未在中国上市,暂不考虑方案一。考虑到副作用、药物的可及性和家属的意愿,我们为患者制定的三线治疗方案为纳武单抗,每2周一次。选项一暂时不考虑。考虑到副作用、药物的可及性和家属的意愿,我们为患者制定的三线治疗方案为纳武单抗,每2周一次。选项一暂时不考虑。考虑到副作用、药物的可及性和家属的意愿,我们为患者制定的三线治疗方案为纳武单抗,每2周一次。
在使用 的同时,我们还为患者进行了胸腔穿刺和引流。1个月后,CT显示患者病灶稳定,胸水减少,但患者右上叶转移灶增加。与12月20日相比,2月21日原发灶和胸腔积液稳定,但右上肺结节仍在增多;3月21日与2月21日相比,转移灶仍在缓慢增加;直到6月21日,患者的原发肿瘤和胸水一直处于稳定状态,但右上叶的转移正在增加。此时患者同时出现头晕头痛症状,头部增强CT显示头部寡转移。目前,该患者 原发肿瘤和胸腔积液较之前稳定,但转移灶扩大,出现中枢神经系统进展。下一步的治疗方案应该如何调整?
图 5-1 胸部 CT (2020/11/26)
图 5-2 胸部 CT (2020/12/17)
图 5-3 胸部 CT (2021/2/16)
图 5-4 胸部 CT (2021/6/15)
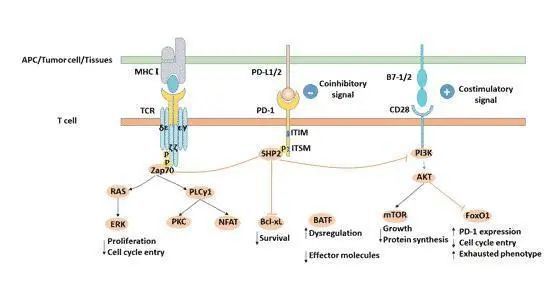
于是我们又对患者进行了基因检测(胸腔积液,NGS技术,1021基因)。这次基因检测发现cis突变消失了,突变又出现了。这样的基因检测结果给我们抛出了一个棘手的问题:患者的四线治疗是否需要接受奥希替尼的挑战?这时候傲世就要再次挑战了。其实,我们有很多顾虑。首先,因为患者已经在二线治疗中使用过奥希替尼并且耐药,所以奥希替尼的疗效能保证吗?其次,二线奥希替尼治疗后,8个月的免疫治疗会影响奥希替尼的疗效吗?第三,目前出现了越来越多的转移和脑转移患者。仅依靠奥希替尼进行四线治疗就足够了吗?
带着这些问题,我们继续回顾文献。首先,针对靶向治疗后穿插免疫治疗再靶向治疗的问题,有研究人员将之前使用过EGFR-TKI治疗的患者分为两组。一组患者在靶向后穿插免疫治疗,然后进行靶向治疗。对于靶向治疗,另一组患者在穿插免疫治疗以外的其他治疗后进行靶向治疗。研究结果发现,靶向耐药、穿插免疫、靶向治疗挑战后的客观缓解率明显高于未穿插免疫治疗的患者[5]。这样的研究结果表明,我们的靶向-免疫-再靶向模型可能使靶向治疗敏感。其次,关于奥希替尼的疗效,有病例报告表明Osi联合Anro可以克服顺式突变引起的Osi耐药[6]。因此,考虑到患者仍有突变和中枢神经系统进展,我们决定采用奥希替尼联合安罗替尼,并辅以颅脑伽马刀治疗作为该患者的四线治疗方案。
事实证明,傲世结合安洛的四线运用并没有让我们失望。7月份患者来复查时,中枢神经系统症状缓解,肺部原发病灶稳定,转移灶减少。疗效评价为PR。直至患者最近一次胸部CT(2021/8/9)),原发灶和转移灶仍稳定,疗效评价为SD。
图 6-1 胸部 CT (2021/7/16)
图 6-2 胸部 CT (2021/8/9)
总结该患者的整个治疗过程,该患者于11月18日确诊为4期肺腺癌,发现EGFR 19外显子缺失。当时,吉非替尼被用作一线治疗。一线格非给患者带来了12个月的PFS。11月19日,患者病情进展,基因检测发现突变,转用二线奥希替尼。奥希替尼似乎在疾病控制方面不尽人意,因此在此期间联合使用了贝伐单抗。奥希替尼联合贝伐珠单抗仍然没有带来预期的效果。1920年,病人的病情再次恶化。基因检测显示顺式突变和高肿瘤突变负荷。所以免疫治疗在三线开始。该 达到了预期,并为患者带来了另外 8 个月的 PFS。直到今年6月,患者转移灶加重,中枢神经系统进展,转用四线奥希替尼联合安罗替尼。目前,患者自确诊以来已获得33个月的生存期。33个月虽然曲折,但也算是一个惊喜。我们可以继续期待奥希替尼和安罗替尼的组合能否给我们带来更多的惊喜。这可以算是一个惊喜。我们可以继续期待奥希替尼和安罗替尼的组合能否给我们带来更多的惊喜。这可以算是一个惊喜。我们可以继续期待奥希替尼和安罗替尼的组合能否给我们带来更多的惊喜。
图7:处理过程总结
回顾患者的整个治疗过程,我们在每次选择治疗方案时都努力尊重患者及其家属的指导方针和意愿。根据患者家属的要求,患者的治疗过程是全程化疗,患者的生活质量还是比较高的。其次,每当患者病情进展时,我们积极动员患者家属进行基因检测,力求做到精准、个体化治疗。对于三线和后三线治疗方案,需要结合患者的实际情况,同时参考最新研究甚至病例报告做出选择。
参考
[1] 于哈, AJ, A, et al. of and on -Free for With EGFR-Lung: A 1/2-Open- [J]. 美国医学会杂志,2020 年,6(7).
[2] H, TOI Y, H, 等。Plus vs in With EGFR – Non-Cell Lung With – [J]. JAMA, 2021, 7(3): 386.
[3]Wang Y,Yang N, Y, et al.:肺 EGFR-//cis-by and [J]. 的, 2020, 15(8).
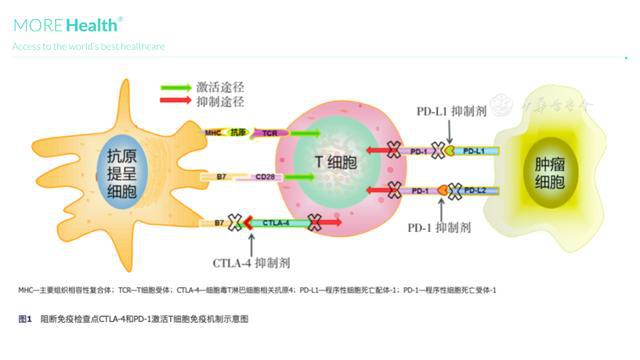
[4] 陆生,等。870. 2020 AACR。
[5] EGFR-TKI PD-1 [J]..
[6] 周茹,宋丽,W,等。和May的顺式EGFR-in:一例[J].以及 2021 年 14:2847-2851.
专家介绍
杨栓英
一级主任医师、教授、博士生、博士后导师。西安交通大学第二附属医院呼吸与危重症医学科主任。为国家卫生事业做出突出贡献的中青年专家。教育部新世纪优秀人才。西安交通大学名医、教师。中华医学会呼吸分会委员、胸膜病学组委员;中华医学会呼吸分会常务委员、肺癌工作委员会委员;国际肺癌研究协会会员;《中华肺病杂志》杂志执行编委,中国肺癌杂志、国际呼吸杂志、现代肿瘤学、中国呼吸与重症监护杂志、西安交通大学学报(医学版)或编委。主持国家自然科学基金4项,以第一或通讯作者发表论文186篇,SCI论文66篇,以第一完成人获得省科技进步一等奖1项、二等奖2项。主编专着1部,参与制定肺癌诊疗相关指南和共识16篇。以第一或通讯作者发表论文186篇,SCI论文66篇,以第一完成人获得省科技进步一等奖1项、二等奖2项。主编专着1部,参与制定肺癌诊疗相关指南和共识16篇。以第一或通讯作者发表论文186篇,SCI论文66篇,以第一完成人获得省科技进步一等奖1项、二等奖2项。主编专着1部,参与制定肺癌诊疗相关指南和共识16篇。
明宗娟
西安交通大学第二附属医院呼吸与危重症医学科副主任医师,在职博士,陕西省过敏性疾病防治委员会常务委员省卫生协会、陕西省肿瘤个体化诊疗委员会委员、书记,陕西省抗癌协会抗癌药物专业委员会委员,主持陕西省自然基金项目1项,参加国家科学基金,以第一作者发表中英文文章10篇,参加陕西省科技进步二等奖1项,参与编着专着1部。
张梦莹
医学博士,毕业于中南大学湘雅医学院,曾就读于密歇根大学(安娜堡)2年。以第一作者发表SCI论文1篇,中文核心期刊论文1篇。
文末排版:
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话