欢迎光临吉康旅!
在延长晚期肺癌患者生存的征程中,表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)从第一代发展到第三代,第一代强于第一代。第三代EGFR-TKI奥希替尼一线治疗确实可以为EGFR突变的晚期非小细胞肺癌带来更多的益处(),但并不是每个患者都这样。如何提前识别这部分效果不佳的患者,目前还缺乏实用的数据和可靠的生物标志物。2021年11月,日本学者蒂森在《欧元杂志》上进行了回顾性研究,并给出了一些初步的答案。
奥希替尼一线治疗PFS和OS效果更好,但无法提前区分哪些患者无效
EGFR突变是患者最常见的驱动基因突变。对于 EGFR 突变的患者,与细胞毒性化疗相比,EGFR-TKIs 延长了无进展生存期 (PFS)。第一代(吉非替尼或厄洛替尼)和第二代(阿法替尼)EGFR-TKI 是 EGFR 突变阳性的初始治疗。
奥西替尼是第三代EGFR-TKI,最初用于二线治疗后介导的耐药患者。在 2018 年的研究(一项涉及先前未治疗的 EGFR 突变阳性患者的随机 III 期试验)中,奥希替尼比第一代 EGFR-TKI 更好地改善了 PFS(18.9 vs 10.2 个月,风险比[HR]0.46, 95% CI 0.37~0.57, P<0.0001)。2019年证实奥希替尼的总生存期(OS)优于第一代 EGFR-TKI。
然而,关于奥希替尼作为初始治疗的可测量预后因素的报道有限。此外,日本亚组研究 OS 的趋势与一般人群不同。此外,日本人群的肺炎发病率高于其他人群。
日本回顾性研究:奥希替尼初始治疗中 PD-L1 表达可预测 PFS 不佳
在“Eur J”中进行的这项回顾性多中心队列研究包括 538 名 EGFR 突变阳性患者,这些患者在 2018 年 8 月至 2019 年 12 月期间最初接受了奥希替尼治疗。
中位观察期为 14.7 个月(四分位距 11.4~20.0)。中位 PFS 为 20.5 个月(95 % CI 18.6~未达到)。
多元分析显示性别(男性)(风险比[HR]1.99, 95%CI 1.35~2.93, P=0.001)@ >、恶性积液(HR1.51,95%CI1.11~2.04,P=0.008),肝转移(HR1.55, 95%CI 1.03~2.33, P=0.037), 晚期不可切除 (HR 1.71, 95%CI ,1.04~2.82,P=0.036),突变类型和程序性细胞死亡配体1(PD-L1)表达与PFS。
(HR 1.55, 95%CI 1.01~2.38, P=0.043) 和罕见突变 (HR 3.15 , 95%CI 1.70~5.83, P<0.001)与PFS有关。
PD-L1表示为1%~49% (HR 1.66, 95%CI 1.05~2.63, P=0.029) , ≥50% (HR 2.24, 95%CI 1.17~4.30, P=0.015) 和未知 (HR 1.@ >53, 95%CI 1.05~2.22, P=0.026) 与PFS有关。
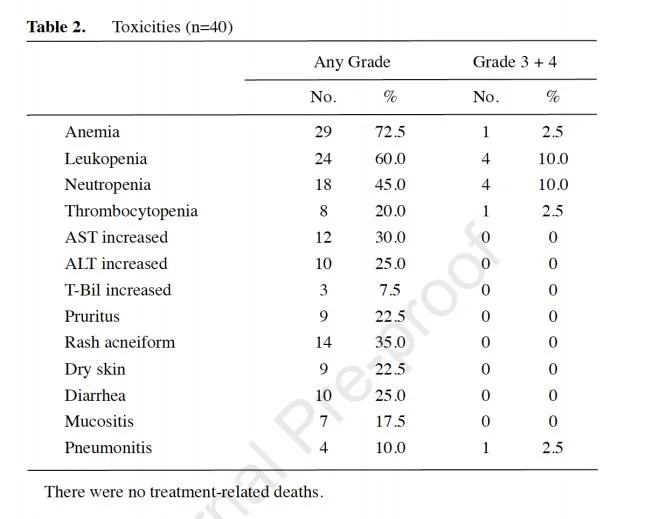
219例患者中止治疗的主要原因是疾病进展(44.3%)、肺炎(25.5%)和其他不良事件(16.0%) .
因此,在奥希替尼初始治疗期间,PD-L1 表达与 PFS 显着相关。值得注意的是,不良事件是停药的重要原因。
PD-L1 高表达的人可能会使用免疫疗法
这是奥希替尼一线治疗实践中的首个大规模回顾性队列研究。已经确定了许多可以在实践中测量的预测 PFS 的生物标志物,以帮助做出治疗决策。关于 PD-L1 表达和突变类型的结果,对于 EGFR 突变阳性患者的初始或后续治疗方案的选择可能很重要。需要仔细评估安全性结果和停药原因。
肿瘤 PD-L1 表达水平是使用免疫检查点抑制剂的已知生物标志物;然而,它也与EGFR-TKI的疗效有关。无论PD-L1的表达如何,奥希替尼的PFS均优于第一代和第二代EGFR-TKI。然而,这些先前的报告存在局限性,包括分析数量少、免疫染色方法存在差异以及 PD-L1 表达的截断值不一致。本研究的优势在于,与之前的报道相比,产品数量足够多,所用的免疫染色方法(22C3))与实际操作有关。
一个重要的新发现是,奥希替尼在 PD-L1 高表达患者的一线治疗中并不那么有效。PD-L1高表达与EGFR-TKI耐药相关的原因尚不完全清楚;然而,PD-L1 表达通过多种机制上调,包括致癌基因激活。例如,YAP(yes- )是一个致癌基因,主要的调控通路;YAP 调节 EGFR-TKI 耐药细胞系中 PD-L1 的表达,而吉非替尼耐药的 PC9 细胞 () YAP 和 PD-L1 表达高于亲本细胞。需要进一步的转化研究来探索使用 PD-L1 表达作为奥希替尼预后生物标志物的意义。
EGFR突变阳性患者二线治疗EGFR-TKI后,可使用免疫检查点抑制剂;化疗后使用免疫检查点抑制剂二线治疗对EGFR突变阳性患者的益处不大。PD-L1的高表达可能预示着免疫检查点抑制剂对EGFR突变阳性患者的疗效。阿特珠单抗+贝伐珠单抗+卡铂和紫杉醇是EGFR突变阳性患者的一种有前景的治疗选择。研究人员认为,免疫检查点抑制剂在EGFR突变阳性肺癌中的应用值得进一步研究。
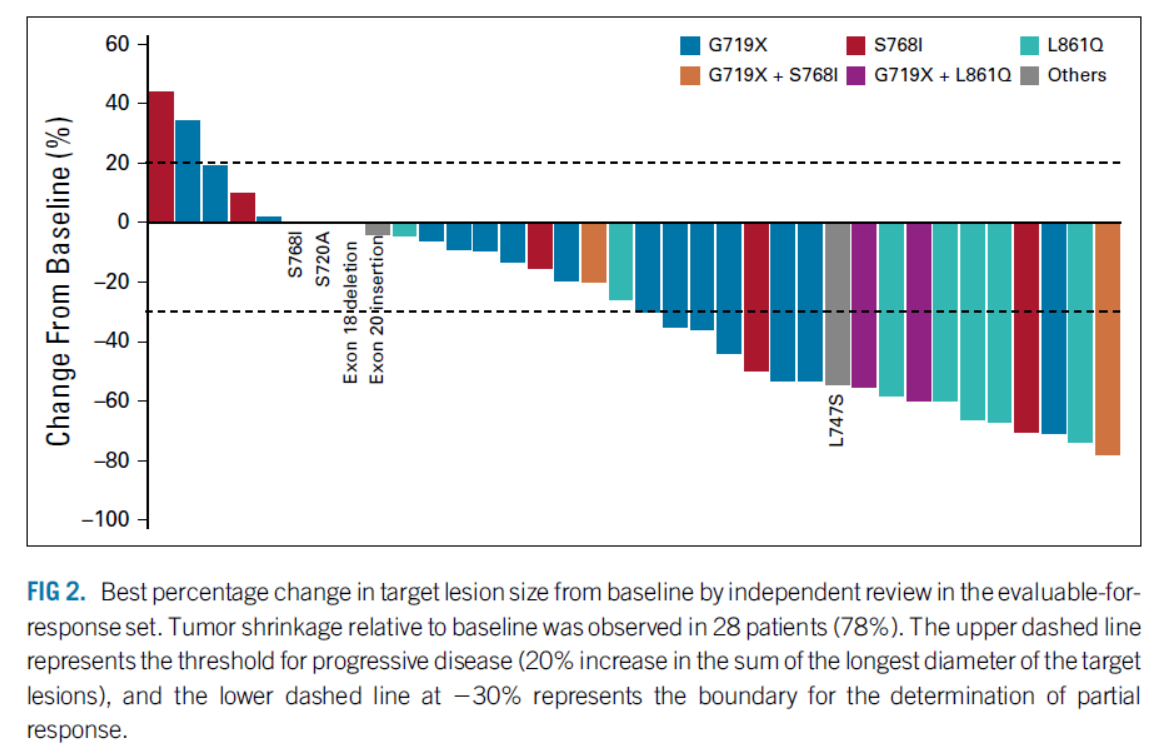
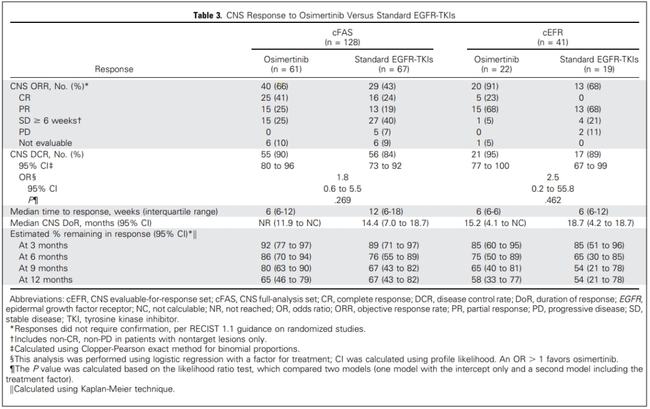
关于突变的类型,EGFR和TKI的治疗效果存在差异,这在之前第一代和第二代EGFR TKI的荟萃分析中已有报道。与第一代二代EGFR TKI相比,一线奥希替尼治疗与PFS的相关性更好;然而,由于只有OS结果的亚组分析,因此患者是否应该接受相同的治疗尚不清楚。
研究表明,在奥希替尼初始治疗期间,不同突变类型的PFS存在显着差异。患者的中位 PFS 为 16.9 个月,相对优于研究。患者的最佳一线治疗仍然存在争议。一项 II 期试验评估了奥赛替尼对罕见突变患者的疗效。结果显示,患者的中位 PFS 为 8.2 个月。然而,这项研究包括以前接受过治疗的患者。本次研究中,中位PFS为7. 8个月,说明病情得到了一定程度的控制。
研究结果表明,日本人群因 AE 导致的停药率可能高于其他人群。本研究中的类似发现。538 名患者中有 219 名在数据截止点停止治疗,其中 91 名(41.2%, 91/219) 因不良事件停止治疗,56 名)(25.@ >6%,56/219)因肺炎停止治疗。此外,因肺炎停止治疗的患者转为二线治疗的比例高于因疾病进展而停止治疗的患者或其他不良事件接受治疗的患者情况更糟。
此外,几乎所有因除肺炎以外的所有不良事件而停止治疗的患者都继续使用EGFR TKI作为二线治疗;56例因肺炎停止治疗的患者,12例(21.4%)不能继续使用其他EGFR TKIs治疗。这表明,当患者在接受奥希替尼治疗后出现肺炎时,往往会避免选择其他 EGFR TKI 进行后续治疗,可能无法充分受益于 EGFR TKI。
综上所述,在现实世界实践中,奥希替尼在一线治疗后已从 PFS 中获益;该研究确定了几个可能影响 EGFR 突变阳性患者治疗策略的疗效预测因素。由于不良事件(尤其是肺炎)是停药的重要原因,研究人员计划继续研究不良事件对长期预后的影响。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话