欢迎光临吉康旅!
自2017年在中国上市以来,奥希替尼已成为众多EGFR阳性晚期肺癌患者的“救命稻草”,因为它成功解决了第一代靶向耐药问题。作为EGFR阳性患者的二线治疗,不仅延长了患者的生存期,而且大大提高了患者的生活质量。当然,奥希替尼不会就此止步。有临床研究报告,奥希替尼在国际上的应用已进入一线临床实践。
在上一篇文章中,我们介绍了奥希替尼的一线使用:
紧接着,很多求知者会考虑,如果一线使用奥希替尼后又对奥希替尼产生耐药性怎么办?对于那些长期坚持与肺癌抗争的求友来说,这是一个不得不面对的严重问题。
今天我们就详细分析一下阻力机制,为大家解开这个疑惑。
1、奥西替尼一线治疗可抑制继发突变,且无转化为小细胞肺癌(SCLC)或肺鳞癌的风险
研究数据显示,如果一线使用具有EGFR靶点的第一代靶向药物,部分患者产生的耐药突变就是EGFR基因位点。此时,患者可以继续使用第三代药物奥希替尼进行治疗。奥希替尼二线耐药会在此基础上产生新的耐药突变,突变率约为20-40%。
下一代靶向药物能否继续重复使用?不确定!
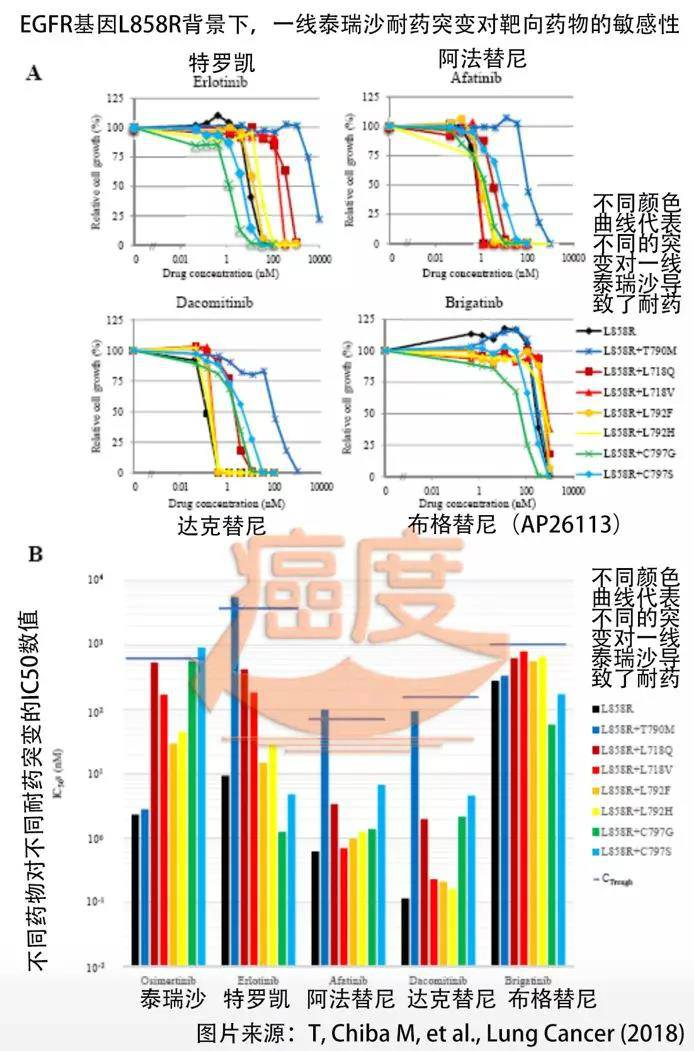
因为这出现的基础是,如果这两个基因的突变位点在同一条染色体上,就是所谓的顺式构型,目前还没有靶向药物来对付。虽然细胞学检测已经证实它可以与EGFR蛋白药物爱必妥()联合使用()。但这种用药策略尚未进入临床阶段,药物的可得性和剂量存在一定的不确定性,存在一定的风险。
面对二线使用奥希替尼耐药的更复杂机制,患者还可能面临转化为小细胞肺癌(SCLC)或肺鳞癌(SqCC)的可能性。但目前奥希替尼一线用药研究资料中未见肺癌亚型转化的报道,未发生继发突变,说明奥希替尼一线药物具有一定优势,后续治疗抗性比较简单。一些。
2、一线使用奥西替尼,有机会使用靶向药物回收
2018 年欧洲肿瘤学会议报告了 91 名 EGFR 阳性肺癌患者。一线使用奥希替尼的耐药机制主要是MET基因扩增(占15%),EGFR基因突变占7%,突变占7%,HER2基因扩增占2%,ALK基因融合突变占1%,BRAF基因突变占3%,KRAS突变占3%,未发生突变,未发生肺癌亚型转化。
一线使用奥希替尼耐药后,若出现MET基因扩增,可将奥希替尼联合MET基因抑制剂进行治疗。如果发生突变,可以使用第一代靶向药物进行治疗。注:此时的突变与二线耐药突变不同,因为二线耐药突变一般与顺式突变共存,一线奥希替尼耐药没有突变,所以单发这时候就可以用回第一代靶向药物了。
这充分证明了一线奥希替尼的益处。不仅一线耐药机制比后线耐药机制相对简单,而且奥希替尼一线耐药后,如果有突变,患者的二线治疗可以继续使用第一代后在靶向药物方面,如果二线治疗失败,如果有突变,患者可以继续回到奥希替尼三线治疗。
3、系统治疗,不怕耐药
一线寻求者使用奥希替尼,可以避免耐药突变的发生,给靶向药物一个回收的机会。即使奥希替尼最终还是产生耐药性,其他靶向耐药靶点的药物仍然可以考虑。
上图为奥西替尼一线耐药后的治疗策略:
2018年,国内报道奥希替尼耐药联合克唑替尼(MET基因扩增靶向药物)治疗晚期非小细胞肺癌成功。研究也证实,如果奥希替尼对一线耐药,患者与该药联用可获得显着获益[4]。
数据或案例
患者接受奥希替尼耐药后,基因检测显示存在EGFR敏感突变,以及MET扩增(+),但没有突变。基因检测结果提示一代TKI联合克唑替尼可能有效,因此患者于2017年2月7日开始使用一代TKI联合克唑替尼治疗。联合治疗42天后,可获得患者的影像结果 明显好转!
当然,还有更多的方案等待科学家去探索,联合抗血管生成药物或联合化疗。免疫治疗目前对EGFR突变靶向耐药的患者组支持度不高,除非患者有更高的证据支持(如高PDL1表达、高TMB负载等)。
抗癌是一场持久战,耐药性在所难免。但是,可以灵活使用靶向药物来延缓耐药性的发生,或者在合适的时间使用合适的药物或组合来遏制癌细胞。相信随着科技的发展,新药的研发不断加快,非小细胞肺癌患者的长期生存将不再只是梦想。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话