欢迎光临吉康旅!
肝癌是我国第四大常见恶性肿瘤,死亡率已位居第二。以目前的诊疗水平,中国肝癌患者的整体5年生存率不到20%。2021 年 7 月,一项随机、开放标签、II~III 期研究“,”在中国调查了联合药物和索拉非尼治疗肝细胞癌 (HCC) 的效果。
背景:中国是HCC的高负担国家,乙型肝炎病毒(HBV)感染是主要的致病因素。HCC患者预后较差,大量临床需求未得到满足。Ⅱ~Ⅲ-32 期研究旨在评估 (一种 PD-1 抑制剂)联合(贝伐单抗的一种生物类似物)与索拉非尼作为不可切除的 HBV 相关 HCC 一线治疗的有效性和安全性。
方法:这项随机、开放标签、II~III 期研究在中国 50 个地区进行。患者入组标准为:18 岁或以上、组织学或细胞学诊断或临床确诊的不可切除或转移性 HCC、既往未接受过全身治疗、基线东部肿瘤协作组 (ECOG) 身体状况为 0 或 1。研究的第二阶段,患者接受静脉注射信迪利单抗(每 3 周一次)+ 静脉注射(15 mg/kg,每 3 周一次)。在第三阶段,患者按照2:1的比例随机分配到+(-生物仿制药组)或索拉非尼(口服,每天2次,索拉非尼)。拉非尼组)直至疾病进展或出现不可接受的毒性。通过交互式网络响应系统,置换块随机化用于随机分组,块大小为6,根据大血管侵犯或肝外转移、基线A-胎儿球蛋白水平和ECOG身体状况分层。该研究 II 期部分的主要终点是安全性,在所有接受过至少一种研究药物的患者中进行评估。III期部分的主要复合终点是独立放射学审查委员会(IRRC)根据实体瘤反应评估标准()1.1版意向-治疗人群。该研究已对新参与者关闭,后续正在进行中以获得长期结果。根据大血管浸润或肝外转移、基线 A 胎儿球蛋白水平和 ECOG 身体状况进行分层。该研究 II 期部分的主要终点是安全性,在所有接受过至少一种研究药物的患者中进行评估。III期部分的主要复合终点是独立放射学审查委员会(IRRC)根据实体瘤反应评估标准()1.1版意向-治疗人群。该研究已对新参与者关闭,后续正在进行中以获得长期结果。根据大血管浸润或肝外转移、基线 A 胎儿球蛋白水平和 ECOG 身体状况进行分层。该研究 II 期部分的主要终点是安全性,在所有接受过至少一种研究药物的患者中进行评估。III期部分的主要复合终点是独立放射学审查委员会(IRRC)根据实体瘤反应评估标准()1.1版意向-治疗人群。该研究已对新参与者关闭,后续正在进行中以获得长期结果。该研究 II 期部分的主要终点是安全性,在所有接受过至少一种研究药物的患者中进行评估。III期部分的主要复合终点是独立放射学审查委员会(IRRC)根据实体瘤反应评估标准()1.1版意向-治疗人群。该研究已对新参与者关闭,后续正在进行中以获得长期结果。该研究 II 期部分的主要终点是安全性,在所有接受过至少一种研究药物的患者中进行评估。III期部分的主要复合终点是独立放射学审查委员会(IRRC)根据实体瘤反应评估标准()1.1版意向-治疗人群。该研究已对新参与者关闭,后续正在进行中以获得长期结果。III期部分的主要复合终点是独立放射学审查委员会(IRRC)根据实体瘤反应评估标准()1.1版意向-治疗人群。该研究已对新参与者关闭,后续正在进行中以获得长期结果。III期部分的主要复合终点是独立放射学审查委员会(IRRC)根据实体瘤反应评估标准()1.1版意向-治疗人群。该研究已对新参与者关闭,后续正在进行中以获得长期结果。
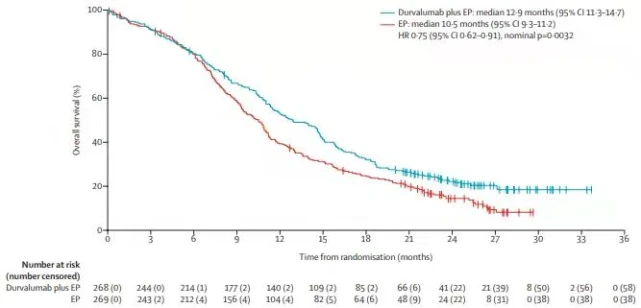
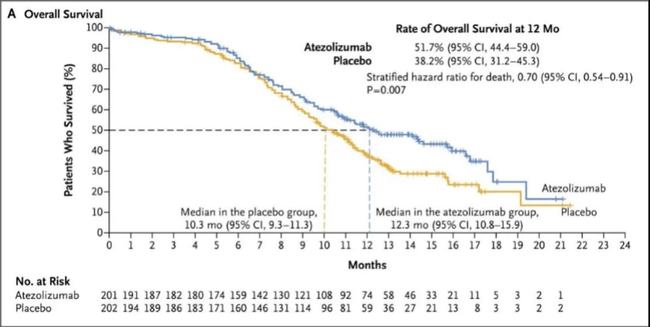
结果:2019年2月11日至2020年1月15日,研究者共入组595例患者:24例直接纳入II期安全性试验部分,571例随机分配至 + 抗生素组(380人)或索拉非尼组( 191 人)。第二阶段,24名患者接受至少一种研究药物治疗,客观缓解率为25.0%(95% CI,9.8~46.7)@ >. 基于 II 期试验的初步安全性和活性数据(其中 7/24 人 [9%] 经历了 3 级或以上的治疗相关不良事件),开始了一项随机 III 期试验。 2020年8月15日)信迪利单抗组和索拉非尼组的中位随访时间为10.0个月(IQR,8.5~11.7)@>和1 0.0 个月 (< @8.4~11.7)@>。信迪利单抗组的 IRRC 显着长于索拉非尼组 中位无进展生存期(4.6[95% CI, 4.1~5.7] vs 2.8 [2.7~3.2] 个月;分层 HR,0.56;95% CI,0.46~0.70;P
结论:在中国不可切除的HBV相关HCC患者中,与索拉非尼相比,作为一线治疗药物,+显示出显着的总生存期和无进展生存期获益,具有可接受的安全性特征。该联合方案为此类患者提供了新的治疗选择。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话