欢迎光临吉康旅!
马文斌教授
北京协和医院神经外科主任,中国医师协会胶质瘤专业委员会副主任委员,中国胶质瘤合作组组长。
1
胶质瘤的临床状况:
2002年之前,诊断GBM后不到1年的MS患者,5yr-SR不到3%(美国)。方案后无进展生存期为6. 9个月,绝大多数GBM在6-11个月内复发-进展。
恶性肿瘤的十大特征:
1、自给增长信号;2、 对增长信号不敏感;3、 抗细胞死亡;4、 无限的复制潜力;5、 连续血管生成;6、 组织浸润和转移;7、 避免免疫破坏;8、 促进肿瘤炎症;9、 细胞能量异常;10、 基因组不稳定和突变。
肿瘤系统治疗化疗/分子靶向治疗/免疫治疗:
1、传统化疗方法可用于各种肿瘤,通常使用细胞毒性强的小分子药物攻击增殖较快的肿瘤细胞。化疗的优点是普适性强,至今仍是治疗肿瘤的主要方法。但是,化疗的缺点也很明显。快速增殖的骨髓造血细胞等正常细胞也容易受到药物攻击。其次,临床实践中通常不考虑患者之间的差异。
2、分子靶向治疗是在细胞分子水平,专门选择致癌位点并结合,影响靶分子的肿瘤发生发展及其调控信号转导通路,使肿瘤细胞特异性死亡而不扩散到正常组织肿瘤周围的细胞,达到治疗肿瘤的目的。
3、 肿瘤免疫治疗——应用免疫学原理和方法,提高肿瘤细胞的免疫原性和效应细胞杀伤的敏感性,刺激和增强机体的抗肿瘤免疫反应,应用免疫细胞和效应分子注入宿主体内,配合人体免疫系统杀死和抑制肿瘤的生长。
分子病理学指导下的GBM细胞毒化疗:
1、NOA 8 &:GBM治疗对老年人有预后和预测作用;
2、:在使用剂量增强方案治疗 Rgbm 时,MGMT 启动子去甲基化是预后获益的分子标记;
3、:当AO起源人群接受PVC化疗时,MGMT-甲基化状态可以预测OS和PFS的益处;
4、:DLGG 高危人群,无论是否联合 1p/19q,MGMT 评分较高者均可受益于 TMZ 化疗。
2
已完成III期临床药物试验的重要分子靶向药物:贝伐单抗、依维莫司、尼妥珠单抗。
一、抗血管生成靶向药物-贝伐单抗
研究结果:
1、与非抗血管药物相比,抗血管药物不能有效提高高级别胶质瘤(HGG)患者的生存时间(OS);
2、两者相比,抗血管药物可以显着提高HGG的无进展生存时间(PFS);
3、 与单独化疗药物相比,化疗药物加抗血管药物不能有效提高HGG的OS;
4、 与单独化疗药物相比,化疗药物加抗血管药物可以显着提高HGG的PFS;
5、 抗血管药物对患者生活质量的影响仍存在争议。
6、 与非抗血管药物相比,贝伐单抗(一种抗血管药物)具有理想的副作用。
临床研究结果支持在 GBM 中使用贝伐单抗:
在复发性GBM中,贝伐珠单抗与历史对照相比显示出显着的临床获益:根据2009年公布的II期研究结果,贝伐珠单抗已被包括美国在内的全球近40个国家批准用于治疗复发性GBM。
后来数据重新分析和重新研究得到了新的结论:
1、不同分子类型对nGBM/rGBM BEV治疗的预测作用;
2、不同的分子类型在BEV治疗的转录组学上有不同的变化;
3、利用基因表达谱预测BEV的治疗效果;
4、影像标志物可以预测BEV的疗效。
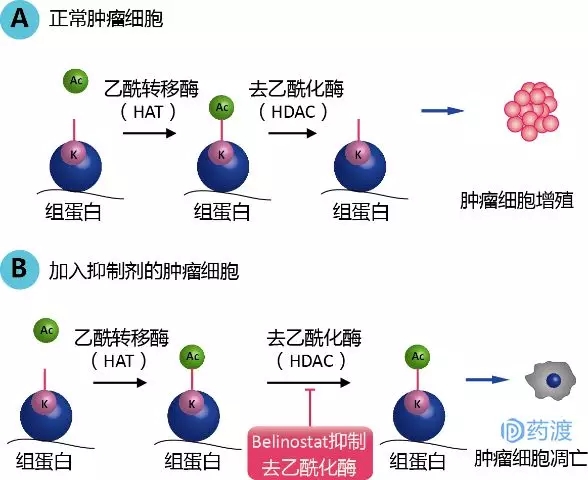
二、AKT/PTEN/Mtor通路抑制剂——
1、 结节性硬化症(TSC)是一种遗传性疾病,是TSC1或TSC2基因突变的结果;基因突变会导致mTOR信号通路异常高激活;
2、 20%的结节性硬化症患者伴有脑室下巨细胞星形细胞瘤(SEGA),常发生于儿童和青少年;
3、 预计依维莫司治疗可能对无症状、双侧肿瘤和较大损伤,或儿童SEGA更有效;
4、SEGA患者使用依维莫司(口服3mg/m2/d)6个月,肿瘤体积逐渐缩小>30%;
5、 与安慰剂相比,口服依维莫司使超过 50% 的 SEGA 患者的肿瘤体积减少了 35%。
2013 年发表的一项研究结论:
本研究的结果支持使用依维莫司治疗伴脑室下巨细胞星形细胞瘤的结节性硬化症。此外,该药物已显示对结节性硬化症的其他方面具有改善疾病的作用。
AKT/PTEN/mTOR通路抑制剂——:
对于新治疗的分子病理学nGBM患者,治疗前肿瘤组织发生磷酸化的患者可以存活并受益于治疗。
三、EGFR单克隆抗体-尼妥珠单抗
1、 特异性阻断EGFR信号通路;
2、 介导ADCC、CDC等免疫效应;
3、 导致 EGFR 内吞和降解。
在 GBM 患者中,它占大多数。如果这类患者有 Akt 或信号激活,尼妥珠单抗治疗可能会受益。当研究队列使用 P-RPS6 作为激活标志物时,有可能在整个组中发现尼妥珠单抗获益的趋势。使用候选预测分子标志物进行患者队列选择,可作为未来尼妥珠单抗等EGFR和mTOR抑制剂临床应用研究的基础。
3
胶质母细胞瘤II期临床试验中重要的分子靶向药物:、、硼替佐米、维罗非尼、、ABT-414、。
一、多靶点酪氨酸激酶抑制-
是一种口服多靶点酪氨酸激酶抑制剂(TKI),可抑制血管生成和其他肿瘤驱动基因通路,如-3、、FGFR、血管生成素受体TIE-2、酪氨酸激酶受体、受体酪氨酸激酶基因、白血病致病因子1、BRAF基因等蛋白激酶活性,因此可阻断肿瘤血管生成,抑制肿瘤细胞增殖,调节肿瘤微环境,从而抑制肿瘤增殖和侵袭。
瑞戈非尼于 2012 年 9 月被美国 FDA 批准用于治疗先前接受过标准治疗的转移性结直肠癌 (mCRC) 患者。原发性肝癌患者。
一项 II 期临床试验的结果表明,与洛莫司汀相比,接受瑞戈非尼治疗的患者具有总体生存获益。
这表明 在复发性胶质母细胞瘤中具有令人鼓舞的总体生存优势。它可能是一种新的潜在治疗药物,应在 III 期进一步研究。
二、PARP抑制剂——
PARP(聚 ADP 核糖聚合酶)抑制剂通常与 BRCA 突变有关。PARP抑制剂的机制是阻断DNA单链的修复。由于缺乏 BRCA 编码的蛋白质,具有 BRCA 突变的肿瘤细胞无法通过。源头重组修复DNA双链断裂,最终导致肿瘤细胞死亡。
新治疗的胶质母细胞瘤联合TMZ同步放化疗和辅助化疗,患者耐受性好,每周剂量可达17.2 mg/kg。与历史数据相比,实验组的中位生存时间明显延长,这种治疗模式的增强具有潜在的抗肿瘤作用。在进行其他治疗效果研究之前,应进行药物剂量优化。
三、蛋白酶体抑制剂——
1、泛素-蛋白酶体途径(UPP)是生物体中除溶酶体途径之外的另一个重要的细胞内蛋白水解途径。水解过程由蛋白质泛素化和蛋白质水解两部分组成。水解蛋白主要发生在26S蛋白酶体(2 19S复合体+20S蛋白酶体)中。
2、 与癌症的相关性:蛋白酶体可通过水解过快的细胞内短寿命蛋白质,如NF-KB、P53、C-moc、A等,间接调节细胞有丝分裂周期、凋亡和信号转导等。跨膜定位等。
3、 基因组不稳定性和快速增殖使肿瘤细胞更加依赖蛋白酶体去除错误折叠或损坏的蛋白质。事实上,原发肿瘤中蛋白酶体的水平和活性远高于正常组织。
近年来,蛋白酶体抑制剂在抗肿瘤领域受到关注——如硼替佐米和卡非佐米,它们于2015年被FDA批准为孤儿药,用于治疗胶质母细胞瘤。
硼替佐米抑制细胞粘附、血管生成和细胞因子介导的细胞间通讯,从而影响肿瘤微环境。此外,硼替佐米还可抑制NF-通路,具有化疗增敏作用。
四、BRAF抑制剂-
药物机制:
1、BRAF 基因是 RAF 丝氨酸苏氨酸激酶家族 (ARAF\BRAF\CRAF) 的成员。它是一种致癌基因,其产物蛋白称为B-raf蛋白,它是RAS-RAF-MEK-ERK-MAP细胞内信号通路的参与者,在细胞增殖、分化、凋亡和存活中起着至关重要的作用;
2、BRAF突变与15%的人类癌症有关,包括恶性黑色素瘤、甲状腺乳头状癌、直肠癌、交界性卵巢癌等;
3、中枢神经系统肿瘤中最常见的突变是一种突变,它使B-raf蛋白中的第600个氨基酸将谷氨酸(V)替换为缬氨酸,使其激酶活性大大增加。
部分研究成果:
1、 突变最常发生在儿科患者中,而在成人患者中很少见。
2、 主要见于局灶性/间变性PXA、神经节细胞胶质瘤(III级)、毛细胞星形细胞瘤和上皮样GBM,但很少见于弥漫性胶状肿块中。
3、 是一种 BRAF 抑制剂,已被 FDA 批准用于治疗具有突变的黑色素瘤。
II期临床试验研究的结论:
对于一些有突变的胶质瘤患者,虽然组织学差异导致抗肿瘤效率不同,但有客观证据表明维罗非尼具有抗肿瘤活性和长期持久性。对于原发性脑肿瘤,应优化维罗非尼的治疗。该方案值得继续研究,应确认不同组织类型药物反应的不同驱动机制。
五、间充质转化因子(MET)通路抑制剂——
HGF/c-MET 途径:
间充质上皮转化因子(MET)是受体酪氨酸激酶家族的一员,其天然配体为肝细胞生长因子(HGF),两者共同构成HGFc-MET信号通路。
在正常情况下,c-MET和HGF的结合是维持正常生理功能所必需的,并受到机体的严格调控。
HGFc-MET信号通路的异常激活存在于多种恶性肿瘤中。
该通路的异常激活机制包括:
1、土地依赖途径:HGF的旁分泌和自分泌;
2、 非配体依赖性通路:c-MET基因过表达、突变、扩增、异位、重排、抑制剂缺失等。
3、MET 配体 HGF 的过度表达。
奥那珠单抗:
在临床前研究中证实的人源化单克隆抗 MET 抗体可以抑制胶质母细胞瘤的生长。
在HGF高表达的患者中,Ona+Bev的治疗效果明显更好。
在患者亚组中,Ona+Bev方案的治疗效果明显优于BEV单药方案。
结论:在未分层选择的GBM治疗中,尚无更多数据证明在BEV基础上加Ona能取得比Bev加安慰剂更好的疗效;分子标记探索研究表明,亚组中 HGF 高表达的患者和 Ona+Bev 可以从联合治疗中受益。
六、抑制剂——/
1、 封闭肿瘤细胞膜,减少肿瘤细胞的侵袭性生长。
2、 封闭肿瘤细胞膜,减少活化T淋巴细胞(CD95+)的凋亡,增加抗肿瘤T淋巴细胞的数量;
3、 封闭肿瘤组织血管内皮细胞膜上的表达,减少活化T淋巴细胞(CD95+)的凋亡,增加抗肿瘤T淋巴细胞的数量。
已发表的研究成果:
在临床 II 期试验中达到了所有终点:
1、 (PFS6):达到统计显着性水平;
2、 次要终点(0S):延长ITT人群的OS;
3、 生物标志物阳性患者的生存时间显示出显着的高水平获益;
4、生物标志物可以预测对治疗的反应。
在长达 2 年的治疗期间:
1、 未观察到严重的药物相关不良事件;
2、 的安全性很好,耐受性也很好。
七、-drug (ADC) 抗体药物偶联物
抗表皮生长因子受体单克隆抗体-甲基 F (MMAF)偶联物ABT-414
1、减少副作用;
2、 避免多种EGFR信号转导耐药机制;
3、穿越血脑屏障。
抗体药物偶联物——ABT-414
大约 50% 的 GBM 是 EGFR 扩增/激活的肿瘤;
大约 50% 的 EGFR 扩增/激活肿瘤是 EGFR III (III) 突变 (-7).
临床前测试:
1、ABT-414 保留了 ABT-806 的结合和功能位点;
2、ABT-414对体外表达EGFR的细胞有细胞毒作用;
3、ABT-414在体外对EGFR野生型和EGFR突变型细胞有不同的作用;
4、ABT-414在GBM模型中的效果。
临床试验:
1、2017 年,ASCO 宣布 EGFR 扩增的 126 个 rGBM 中有 47% 为突变阳性。应用 ABT-414 的有效性和安全性的结果。
2、 ABT-414单药治疗或与TMZ联合治疗患者的综合分析;
3、纳入联合分析的rGBM患者的客观缓解率为10.4%,(1.7% CR和8.7% PR)。可达27.1%,mOS可达8. 5个月,6月份疾病控制率达到52%。
4、 最常见的 ABT-414 相关副作用仍然是眼部毒性(87%),但副作用是可逆的。
2017年SNO会议公布了ABT-414联合TMZ治疗EGFR过表达复发性GBM的II期临床试验结果。单独使用 ABT-414 组与单独使用化疗组(TMZ 或 CCNU)相比,两组的 OS 没有显着差异;相比之下,联合治疗组(ABT-414+TMZ)有生存获益趋势,(HR0. 7. 95%CI0.50-1.02,P=< @0.06). 与组不同。
4
美国版精准医学背景:构建基于生物大数据的生物医学研究知识网络,建立新的疾病分类体系,从而定义新的疾病或对疾病进行分子分类和药物分层,从而实现精准诊断,精准治疗。
只有在大数据的基础上进行分子分型,寻找预测特定肿瘤靶向治疗的特异性分子影像标志物,才能进行真正的靶向治疗。
根据马文斌教授的学术报告编辑整理
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话