欢迎光临吉康旅!
近年来,随着分子遗传学和分子生物学在肿瘤研究中的应用,胶质瘤的分子发病机制逐渐被认识。胶质瘤的恶性表型包括癌基因的扩增和过度表达、抑癌基因的缺失以及一些重要信号转导通路的异常。这些分子变化影响胶质瘤细胞的增殖、凋亡、血管生成、侵袭和转移等一系列生物学行为。针对上述途径中胶质瘤组织或细胞中特定或相对特定分子的分子靶向治疗近年来取得了进展,有望成为传统细胞毒化疗以外的肿瘤化疗的突破口。张俊平,三博脑科医院神经肿瘤化疗中心,
01
BRAF 突变抑制剂
在胶质瘤中,BRAF 突变是一个不良的预后特征。该突变主要发生在儿童低级别胶质瘤中,成人胶质瘤中突变率较低。BRAF突变抑制剂达拉非尼和MEK抑制剂曲美替尼联合治疗脑胶质瘤的研究对BRAF突变脑胶质瘤取得了良好的治疗效果,高级别胶质瘤客观缓解率为29%(CR+PR),低级别胶质瘤为62%(CR+PR+MR),肿瘤对药物反应的持续时间更长,常持续1年以上。此外,根据年龄分层,40岁以下患者对药物的客观反应率较高,而40岁以上患者的客观反应率较低;无进展生存时间和总生存时间也与年龄分层密切相关。40岁以下患者预后较好。该研究有望为BRAF突变型胶质瘤患者带来新的希望。
02
/2/3、ROS1 或 ALK 基因融合酪氨酸激酶抑制剂
()是一种新型口服酪氨酸激酶抑制剂,具有中枢神经系统活性,靶向/2/3、ROS1或ALK基因融合,具有高血脑屏障通透性。并不针对特定类型的癌症,而是针对具有NTRK(和)、ROS1或ALK基因融合的不同组织学类型的肿瘤患者,通过这三个基因编码的蛋白质,分别是TRK(TRKA)的组合、TRKB、TRKC)、ROS1和ALK蛋白达到抑制肿瘤的目的。/2/3、ROS1和ALK基因突变和融合存在于多种儿童实体瘤中:婴儿纤维肉瘤(NTRK)、儿童高级别胶质瘤(NTRK、ROS1、ALK)、神经母细胞瘤(ALK)、炎性肌纤维母细胞瘤(ALK、ROS1) 等)。
在恩曲替尼治疗儿童肿瘤(包括5例儿童高级别胶质瘤)-NG的小规模I/IB期临床试验中,12例有2/3、ROS1或ALK,所有基因融合患者均有对 的客观反应(肿瘤缩小或消失),中位治疗持续时间为 281 天;而那些没有靶基因改变的都是无效的。 的大多数治疗相关不良事件是 1/2 级轻度血细胞减少症和胃肠道疾病。总体安全性可控,未发生5级不良事件(死亡)。剂量限制性毒性反应主要是肌酐升高、味觉障碍、疲劳和肺水肿。2例患者出现肺水肿、呼吸困难,停药;11 名患者降低了剂量。导致较低剂量的不良事件包括体重增加、骨折和感觉障碍(味觉障碍、共济失调)。这些剂量限制性毒性值得关注,需要密切观察。
03
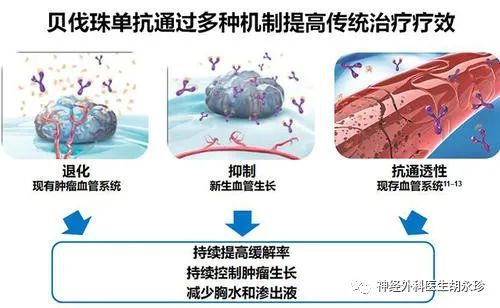
胶质瘤的抗肿瘤血管生成治疗

血管发育不良是高级别胶质瘤的重要病理特征,抗肿瘤血管生成治疗是复发性胶质瘤的重要治疗策略。 (, Bev) 是一种靶向血管内皮生长因子 (, VEGF) 的单克隆抗体。它已在美国获批用于治疗复发性 GBM,但迄今为止(2020 年 5 月)在中国尚未获批用于治疗复发性 GBM。疾病。Bev治疗复发性GBM可延长患者的无进展生存期(free,PFS),但延长总生存期(OS)的效果尚未得到证实。VEGF 以外的其他促血管生成因子的激活是 Bev 抗性的主要原因。研究表明,Bev 治疗失败后,肿瘤的生长更具侵略性,并且目前没有有效的药物来治疗 Bev 失败后的肿瘤进展。需要临床试验来探索可在 Bev 之前应用的有效化疗方案。
04
胶质瘤的免疫检查点抑制剂治疗
免疫检查点抑制剂PD-1和PD-L1相关药物是肿瘤治疗的热门领域,在胶质瘤中也开展了相关研究。迄今为止,唯一取得阳性结果的临床研究是抗PD-1派姆单抗在可切除复发GBM术前新辅助治疗中的应用、术前新辅助和联合术后辅助应用派姆单抗与仅术后辅助应用派姆单抗相比,单克隆抗体显着延长 GBM 复发患者的 PFS(3.3 个月 vs 2.4 个月)和 OS(13.7)。月 vs 7.5 个月)。另一项抗PD-1纳武单抗vs Bev治疗复发性GBM的研究表明,Bev比纳武单抗有更好的PFS(3.5个月对比1. 5 个月),两者的 OS 没有统计学差异(10.0 个月 vs 9.8 个月)。需要更多的研究来探索免疫检查点抑制剂在胶质瘤中的应用。
05

胶质瘤的肿瘤电场治疗(-,)
肿瘤电场疗法是一种利用低强度、中频电场抑制肿瘤细胞有丝分裂的新型物理疗法。抑制胶质母细胞瘤增殖的最佳频率是通过调整电场贴片的排列来获得更好的电场强度。其作用机制是通过作用于肿瘤细胞的微管蛋白/蛋白产生介电泳作用,抑制肿瘤细胞的有丝分裂;对于放疗/化疗引起的肿瘤细胞DNA损伤,可延缓DNA损伤的修复,在放化疗中发挥作用。协同杀死肿瘤细胞;通过下调BRCA/FANC基因,使DNA复制叉暂停,发生错误和解体,增加DNA单链/双链损伤,从而破坏肿瘤细胞DNA的复制和修复;它还可以抑制肿瘤细胞线粒体自噬增加活性氧的产生并发挥抗肿瘤作用。
新诊断GBM后,接受手术并同时进行TMZ放化疗的患者,随机分为TMZ联合治疗组和TMZ治疗组。结果显示,联合TMZ治疗组的中位生存时间为20.9个月,显着优于单独TMZ治疗组的16个月。
患者肿瘤组织O6-甲基鸟嘌呤-DNA甲基转移酶(O6-DNA,MGMT)基因启动子区的甲基化状态影响患者的疗效。受益于TMZ治疗(联合TMZ组中位生存时间31.6个月,纯TMZ组中位生存时间21.2个月),而MGMT启动子区域未甲基化的患者受益相对较小来自TMZ联合治疗(联合TMZ组的中位生存时间16.9个月,纯TMZ组的中位生存时间14.7个月)。疗效与患者依从性密切相关。每天接受治疗超过18小时的患者比每天接受治疗少于18小时的患者生存时间更长(22.6个月vs19.1个月)。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话