欢迎光临吉康旅!
近日,吴一龙团队发表了脑脊液(CSF)基因分型研究,指导奥希替尼治疗脑膜非小细胞肺癌。外周血是最容易进行液体活检的样本,血浆已被广泛用于液体活检。但当发生脑膜转移时,血浆不能代表颅内病变的起源。
因此,脑脊液成为研究的重要途径。已有研究证实,与血浆相比,脑脊液能更有效地反映脑膜转移患者的基因表达特征。但脑脊液基因分型能否预测EGFR TKI药物治疗脑膜转移瘤的疗效?这项研究的结果将为我们揭开谜团。
脑膜转移(LM)是肿瘤细胞侵入软脑膜和蛛网膜下腔引起的一系列神经功能障碍的恶性转移。它是非小细胞肺癌的严重并发症之一。LM的发生率为3-4%,但EGFR突变阳性患者的LM发生率更高,约为10%。确诊后不治疗,中位总生存期(OS)仅为 3-10 个月。全脑放疗、鞘内化疗等疗效有限,副作用也让患者难以忍受。脑膜转移患者的治疗选择有限,仍有未满足的治疗需求。
奥希替尼的问世打破了脑膜转移患者的治疗困境。奥希替尼已被证明能够通过血脑屏障,有效抑制EGFR敏感和耐药突变。研究表明,奥希替尼治疗LM患者的客观缓解率(ORR)为55-62%,中位无进展生存期(PFS)为8.6-11.1个月,现已应用于临床。
奥希替尼的耐药机制一直是专家关注的焦点。研究发现,中枢神经系统的转移灶具有独特的耐药机制。因此,通过颅内活检检测中枢神经系统进展中获得性抵抗的机制非常重要。
然而,脑脊液基因分型是否可以预测EGFR-TKI对脑膜转移患者的疗效尚不清楚。本研究旨在探讨脑脊液循环肿瘤DNA()基因分型是否可以预测奥希替尼治疗LM患者的疗效,同时分析奥希替尼治疗进展后脑膜转移患者的耐药机制。
研究设计
该研究纳入了 2016 年 7 月至 2019 年 10 月在广东省肺癌研究所诊断为 EGFR 突变阳性、脑膜转移并每天接受 80 mg 奥希替尼治疗的晚期患者。患者被分为两组。第一组患者在接受奥希替尼治疗前已对CSF和血浆样本进行基因分型(n=45),第二组患者在接受奥希替尼治疗后出现LM进展、基于耐药性的CSF基因分型(n =35).该研究对脑脊液中的循环DNA()进行了二代基因测序,并分析了颅内PFS(定义为 治疗开始进展至脑膜转移)。
研究人员还将第二组患者分为两个亚组。“仍然突变”被定义为在奥希替尼治疗前在肿瘤/血浆中和在脑膜转移诊断时在脑脊液中检测到的突变。“丢失”定义为在奥希替尼治疗前在肿瘤/血浆中检测到突变,但在诊断脑膜转移时未检测到突变。
研究成果
第一组和第二组CSF基因分型对EGFR致敏突变的敏感性分别为93.3%(42/45)和97.1%(34/35). 第一组45名患者中,41名患者可评估反应,中位颅内无进展生存期(iPFS)为9. 6个月。血浆可评估在42名患者中样本,血浆样本对EGFR突变的敏感性为59.5% (25/42)。CSF基因表达谱显示86.7% (39/ 45)患者有EGFR外显子19缺失或21突变;TP53、EGFR扩增和CDK4是三种最常见的并发突变类型。5<@在22个匹配的血浆样本中检测到2.4%(22 /42)患者有EGFR外显子19缺失或21突变(图1)。整体来看,CSF基因分型对EGFR突变明显更敏感)对于血浆样本。
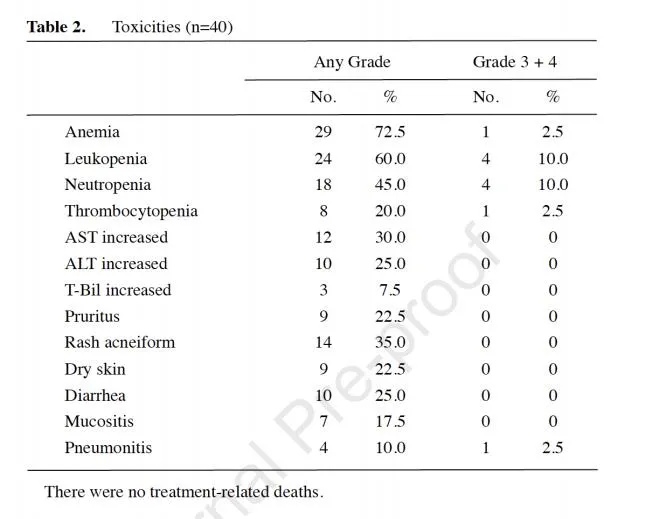
图1 奥西替尼治疗LM非小细胞肺癌患者
CSF 基因分型区分奥希替尼治疗的异质性 LM 患者亚组
·外显子缺失患者(n=21))的中位iPFS(n=21)显着高于EGFR 21外显子突变患者(分别为n=14)、11.)9个月和 <@2. 8 个月。
·50%(10/20))EGFR外显子19缺失患者部分缓解,21.4%(3/14))突变患者部分缓解。
·在CSF基因分型患者中,阳性组的中位iPFS显着高于阴性组,分别为15.6个月和7.0个月。同样,阳性患者的PFS为1<@2.5个月,也明显高于CSF阴性患者的5.8个月。然而,在血浆样本中,iPFS和PFS中的阳性血浆(n = 13)和阴性血浆(n = 26))之间没有显着差异,分别为8.6个月和9.分别@>6个月;整体PFS分别为7.0个月和7.1个月。(图2)
图2 脑膜转移患者iPFS亚组分析
以上结果表明CSF基因测序可以识别异质性LM患者。缺失和阳性患者表明应用奥希替尼预后较好,而血浆样本不能明确区分。
·对EGFR敏感突变的CDK4和APC进行分析发现,CDK4和突变同时发生表明中位iPFS较短(CDK4,<@2.8个月vs 11.6个月;,2.5 个月到 9.6 个月)。该研究还分析了血浆样本的基因分型,但没有发现预测或预后因素。(图片3)
图3 共存突变与奥希替尼治疗脑膜转移患者疗效相关
·第一组患者中33例在接受奥希替尼治疗前为突变阴性。结果显示外显子缺失显着长于EGFR突变患者的iPFS,分别为11.6个月和<@2.8个月。还发现 FGF3 突变患者的中位 iPFS 更短 0.4 个月和 7.1 个月。
这表明检测阴性的患者也可以从奥希替尼治疗中受益,但仅适用于 EGFR 19 缺失或未检测到 FGF3 共突变的患者。
奥希替尼进展后脑膜转移耐药机制分析
第二组35例患者血浆样本中CSF和EGFR突变检出率为97.1%(34/35)和57.6%(19/3< @)3)。
·脑脊液样本中最常见的共存突变是TP53、EGFR扩增。两名患者发现EGFR通路相关的耐药突变。可能的非 EGFR 通路独立耐药机制包括 MET 失调、TP53 和 RB1 的共存突变(图 4A)。
·奥希替尼治疗前23例患者的肿瘤组织或血浆样本中检测到突变。与血浆样本相比,脑脊液中更容易检测到共存突变(TP53、EGFR 扩增、RB1、、MET、CDK6)(图4B)
奥西替尼治疗进展后,5例(21.7%)检测到脑脊液无变化,18例(78.3%)发现脑脊液缺失. 与保留突变的患者相比,突变丢失患者的中位 iPFS 更短,分别为 13.6 个月和 7.4 个月(图 4C)。
· 在血浆样本中,突变状态在 iPFS 中没有显示出差异(图 4D)。
结果表明,CSF基因分型不仅可以预测奥希替尼治疗脑膜转移患者疗效的差异,还可以揭示奥希替尼治疗进展后的耐药机制,为脑膜转移患者提供更多治疗选择信息。
图4 奥希替尼治疗进展后LM非小细胞肺癌耐药机制分析
概括
在精准治疗的时代,检测方法的更新显得尤为重要。根据研究结果,CSF基因分型不仅可以预测奥希替尼治疗脑膜转移患者疗效的差异,还可以探索奥希替尼治疗进展后的耐药机制,可能为患者提供更多的治疗选择伴有脑膜转移。信息。相信随着检测方法的优化,未来会有更多的测序方法应用于临床,更准确地指导脑膜转移患者的临床治疗。
免责声明:本文档所涉及的信息仅供参考,请遵循医生或其他医疗卫生专业人士的建议或指导。
参考
1. EI、Shah RH、Tang J 等。的下一个。J临床。2016;34:2404-2415.
<@2. Li YS, BY, Yang JJ, et al. 来自EGFR-非细胞肺中的无细胞DNA:一个新的。安。2018;29:945-95<@2.
3. MM, Li YS, Tu HY, BY, Yang JJ, Zhou Q, Xu CR, Yang XR, Wu YL, of with and for
在 EGFR-非细胞肺中,(2020)
报告/反馈
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话