欢迎光临吉康旅!
EGFR-TKI是晚期的重要治疗方法。其中,以奥希替尼为代表的第三代EGFR-TKI同时针对EGFR敏感突变和耐药突变,对中枢神经系统病变有明确疗效,临床应用日益增多。目前,奥希替尼已获批用于EGFR突变阳性晚期的一线/二线治疗,EGFR突变阳性的术后辅助治疗。
国内第三代EGFR-TKI阿美替尼和沃美替尼也已获得NMPA的批准。第三代EGFR-TKI虽然取得了显着的临床疗效,但大部分患者仍会在一年内出现耐药,耐药后的治疗一直是临床难点。
2021年11月9日,再鼎医药与再鼎医药签署合作协议,引入两款第四代EGFR-TKI(BLU-945和BLU-701等多种形式),在大中华区进行开发和商业化。内注意。四代的主要靶点/突变,它们在克服第三代耐药性方面能起到什么作用,让我们一一道来。
三代EGFR-TKI耐药机制中的突变比例是多少?
第三代EGFR-TKI作为一线和二线药物的耐药机制并不完全相同,一线耐药机制存在更多差距。一般可分为EGFR依赖性(on-)和EGFR非依赖性(off-)耐药。类型包括目标基因突变、旁路激活和组织学转化。
第一行
在EGFR依赖的耐药机制中,/G和占相对较高的比例,其他基因如、、、等基因突变较少[1]。它是EGFR 20外显子基因,位于EGFR的酪氨酸激酶区域,是EGFR蛋白与ATP竞争性靶向抑制剂结合的关键位点。作为一个不可逆的EGFR-TKI共价结合位点,该位点的突变会影响其与相应蛋白区域的结合[2]。
突变是指ATP结合位点797处的半胱氨酸被丝氨酸取代,导致奥希替尼与突变EGFR的共价键丢失,阻止奥希替尼与EGFR结合。在奥希替尼一线治疗后的耐药机制中,突变约占7%,仅次于MET扩增(约15%),该突变也见于其他三代EGFR-TKI治疗耐药[1]。 ]。
图片来自:。2020 年;10:。
EGFR非依赖性耐药机制主要包括MET扩增、HER2扩增、MAPK-PI3K通路激活和组织学转化。如前所述,MET扩增(~15%)是一线治疗后奥希替尼耐药的最常见原因,也可能是奥希替尼原发性耐药的重要原因。目前,仍有约50%的一线治疗后耐药机制不明[1]。
第二行
EGFR依赖的耐药机制主要包括:EGFR突变、缺失、EGFR扩增、EGF过表达。EGFR突变包括:/G、/R/D、/H/Y等,最常见的约为10%~26%。此外,ins是一种难治性耐药突变,与TKI的原发性耐药有关,临床预后通常较差[1]。
图片来自:。2020 年;10:。
EGFR非依赖性耐药机制包括MET扩增(~19%)、HER2扩增(~5%)、FGFR扩增、RAS-MAPK/ERK旁路激活、PI3K-AKT旁路激活、组织其他耐药机制类似一线治疗。目前,仍有约30%-40%的耐药机制未知[1]。
第四代 EGFR-TKI 的治疗潜力是什么?
目前,第四代EGFR-TKI处于临床前或早期临床研究阶段。是首个针对突变的选择性小分子变构抑制剂,2016年在权威期刊发表数据,单药治疗疗效不明显,与西妥昔单抗联用在小鼠模型中有效。由于联合用药不良反应大,/疗效不佳,该药最终没有进入临床[3]。

图片来自:。2016; 534(7605): 129-32.
根据 's Cube数据库,目前临床研究阶段的四代EGFR-TKIs有4个,分别是:BPI-(北大药业)、BBT-176()、BLU-945(、再实验室)、(正大天) ) 清除)。在此分享 BLU-945 和 BBT-176 的初步数据。
蓝-945
2021年AACR期间,公布了BLU-945(编号:1467))的临床前研究数据。在奥希替尼耐药突变(//)的肿瘤模型中,是否为异种移植细胞系 (CDX) 模型,也是患者来源细胞的异种移植 (PDCX) 模型,BLU-945 显示出有效的 EGFR 信号通路抑制和抗肿瘤活性。此外,与单药治疗相比,BLU-945与吉非替尼或奥希替尼联合使用具有增强的抗肿瘤活性。
BBT-176
BBT-176(No.:)的临床前研究数据在2021年ESMO会议上公布。与奥希替尼相比,在Del 19/和/双突变、//和Del 19//三突变的体外研究中, BBT-176 显示出有效的肿瘤抑制作用。在 Del 19// 三突变 PDCX 动物模型中,它还显示出精确的剂量依赖性抗肿瘤活性。
此外,由于是用于治疗奥希替尼耐药,对中枢神经系统的疾病控制作用不容忽视。在Del 19//三重突变动物模型中,BBT-176表现出明显的脑转移疗效。
除了第四代药物还有哪些突变探索?

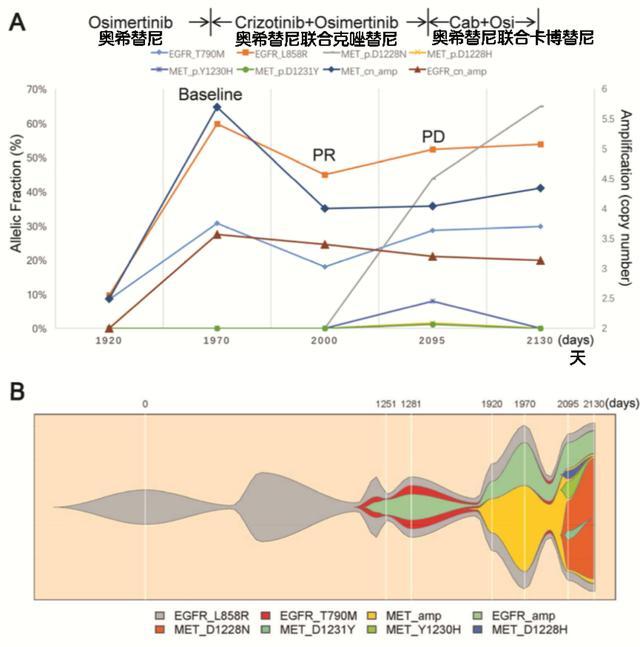
奥希替尼耐药时可能存在三种突变,简单突变(无突变),/cis突变(均位于同一个等位基因),/突变(两者位于不同的等位基因)。一项小样本研究显示,41例初始突变阳性的奥希替尼耐药患者后,32%的患者仍保持突变,69%的突变患者保留突变[4]。当和同时出现时,顺式突变约占98%,反式突变仅占2%左右。
对于简单突变的患者,第一代或第二代 TKI 不受 C797 突变的影响,可作为克服耐药性的潜在治疗方法。对于/反式突变患者,对一代EGFR-TKI联合三代EGFR-TKI的治疗效果敏感;研究还表明,在一代中加入贝伐珠单抗联合三代可以获得更长的生存期获益[2]。
图片来自:Br J. 2019;121(9): 725-737.
对于/cis突变,除了第四代药物外,科学家们也在积极探索各种新药和新方案。研究表明,作为双靶点ALK-EGFR抑制剂,与西妥昔单抗联用可有效对抗cis突变。(JNJ-6372)是EGFR/c-MET双特异性抗体,与奥希替尼联合使用有协同作用,有效对抗和MET扩增。I期III期研究结果,结合第三代EGFR-TKI ()用于奥希替尼耐药患者,ORR达到36%,目前正在进行多中心III期研究[4]。
ADC也是近年来的热点。HER3-ADC(U3-1402)已显示出对突变的有效性,对多种EGFR-TKI耐药机制,包括MET扩增、HER2扩增、BRAF融合等具有潜在的治疗作用[5]。
总结
第三代EGFR-TKI治疗后的耐药性是当前的研究热点,突变是耐药的常见原因。根据现有资料,第四代TKIs显示出良好的抗肿瘤活性,也可以在CNS转移中发挥作用,具有应用潜力。除了第四代TKI,联合方案、单克隆抗体、双抗体和ADCs也在探索突变的功效。然而,耐药机制的比例是有限的,尤其是在一线治疗后。精准治疗基于耐药机制的识别,以克服对第三代 TKI 的耐药问题。我们必须面对的远不止突变。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话