欢迎光临吉康旅!
在2011年世界肺癌大会(WCLC)上,除了以表皮生长因子受体(EGFR)、c-Met、ALK和血管生成抑制剂为靶点的药物的最新研究进展外,基于分子变化的研究更加引人注目。该领域的肺癌研究贯穿于肺癌的流行病学、诊断、治疗、预测和预后等方面。一些研究结果表明,晚期肺癌的治疗已进入个体化时代,针对患者具体分子分类制定的治疗方案可能最大程度地使患者受益。本文对分子分型的研究进行了全面的报道。广州医科大学附属肿瘤医院胸外科 薛星阳
基于组织学类型的肺癌分子分型
传统的非小细胞肺癌()被认为是单一的疾病体。然而,最近的研究表明,腺癌和鳞癌这两个主要亚型对靶向治疗和化疗的反应明显不同,这促使研究作者进一步分析了不同组织学类型的肺癌患者。
肺腺癌美国学者约翰逊()在会议报告中指出,肺腺癌患者的功能驱动基因突变率为54%。516例晚期肺腺癌基因型分析结果显示,KRAS突变率为23%,EGFR突变率为18%,EML4-ALK融合率为9%,BRAF和突变率为 2%。其他几项研究也得出了非常相似的结果。虽然 EGFR 和 KRAS 突变都与女性有关,但 EGFR 突变与低年龄和非吸烟状态有关,而 KRAS 突变与高龄和吸烟史有关。
孙教授等对中国非吸烟腺癌患者的研究。显示EGFR和KRAS突变率分别为78.8%和1.9%,EML4-ALK融合发生率为5.8%,人表皮生长因子受体2(HER2)突变率为3.8%。两个研究人群来自不同种族,EGFR和KRAS突变率差异较大,这表明除了考虑组织学类型,我们还需要注意种族差异。
肺鳞癌 近年来,对肺腺癌基因组特征和突变的分析导致了几种有前景的靶向药物的出现,例如吉非替尼等。与肺腺癌相比,肺鳞癌的靶向治疗进展几乎困难重重。但在这次会议上, () 报道了一项肺鳞癌基因组研究结果表明,在大约 63% 的肺鳞癌患者中,至少可以区分一个可能的治疗靶点,但这些靶点需要通过临床前研究模型。研究结果表明,EGFR和MCL1的扩增率分别为20%~25%、8%、10%和10%,BRAF、DDR2的突变率分别为5%、9%、3%、分别为 4%。, PTEN, 突变/缺失率分别为18%和45%,扩增/突变率为9%。在这些分子中,/2、和DDR2抑制剂的临床试验正在计划或正在进行中。
SCLC美国学者()发现82例小细胞肺癌(SCLC)中,EGFR突变2例(2.4%),KRAS突变和突变(1. 2%)。一般而言,所有EGFR/KRAS突变型SCLC只发生在先是腺癌的突变型SCLC,然后是SCLC或有腺癌成分的混合型SCLC,在单纯型SCLC中从未出现过。基于组织学类型的肺癌基因分析结果表明,肺腺癌、鳞状细胞癌和 SCLC 具有不同的基因谱。这有助于选择合适的目标分子进行个体化治疗。
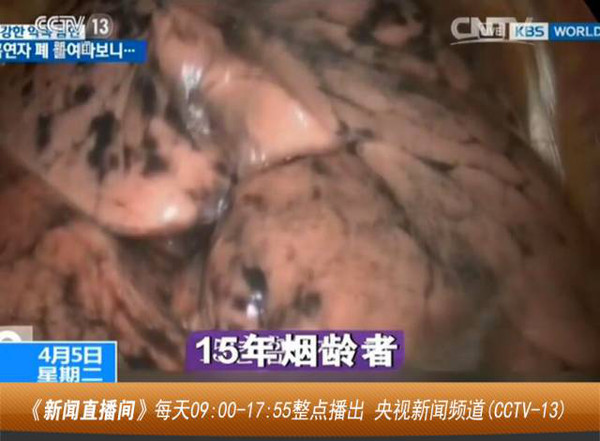
基于吸烟状况的肺癌分子分类
尽管大多数肺癌可能归因于吸烟,但至少有 10% 至 15% 的病例是非吸烟者,而且女性似乎比男性更容易受到吸烟以外的因素的影响。因此,在今年的大会上,非吸烟肺癌备受关注。除了相关的会议报告,还将有与专家面对面的教育会议。
加拿大学者Thu在会上指出,与吸烟的肺癌患者相比,不吸烟者的基因组不稳定程度更高。如果这个结论是正确的,那么对吸烟者和非吸烟者的独立研究和管理可能会使其更容易受益。
早先的研究人员已经观察到吸烟和不吸烟肺癌患者的临床和分子生物学特征是不同的,但对这两种基因组之间的差异数量知之甚少。只是近年来,尤其是在EGFR-酪氨酸激酶抑制剂(TKI)优势人群被确定后,非吸烟者的遗传特征才引起广泛关注。
美国学者Paik比较了301名从不吸烟的患者和373名持续吸烟的肺腺癌患者的驱动基因突变。使用标准方法鉴定 EGFR 和 KRAS 突变,并通过荧光原位杂交 (FISH) 鉴定和使用 ALK 重排。通过聚合酶链反应 (PCR) 方法确认。非吸烟者和吸烟者中EGFR突变率分别为37%和14%,KRAS突变率为4%和43%,ALK融合率分别为12%和2%(P值小于比 0.000 1)。
该研究还分析了基因型和患者存活率。晚期(ⅢB/Ⅳ)不吞咽者和吸吮者的中位生存期分别为53.4个月和24.8个月(P<0.001) . 在非吸烟者中,EGFR、KRAS和ALK变异者的中位总生存期分别为36.6个月、10.4个月和62.9个月;多变量分析显示EGFR 突变与 KRAS 突变、EGFR 突变与 ALK 重排在生存率上存在显着差异;而对于特定的非吸烟者和吸烟者之间的基因型没有显着差异。这表明非吸烟者和吸烟者肺腺癌并不相同的亚组;每个都有一个独特的驱动基因突变。
基于肺癌分子分型的临床试验设计与治疗未来

临床试验设计
大多数以前的临床研究不成功的主要原因之一是缺乏分子标记的人群选择。加拿大学者曹在会上介绍了基于分子标记的临床试验设计思路。大多数关于癌症的临床研究旨在测试新疗法的功效,例如药物、放射或手术。由于患者和肿瘤的遗传异质性,对治疗的反应也是异质的。因此,在设计临床试验时,对具有特定分子特征的人群进行研究,有望获得更理想的结果。
未来
肺癌的治疗正在从“一刀切”模式转向基于基因组特征的个体化治疗模式。目前,常见的驱动基因大多具有较为明确的功能特征和靶向药物,总结如下。
它在某些肺癌亚型中高度表达和突变。EGFR抑制剂在EGFR依赖性肺癌中显示出应用前景。此类药物包括厄洛替尼、吉非替尼、阿法替尼等。
继发性耐药主要发生在第一代抑制剂,主要机制为突变、MET 表达和/或扩增等。目前,在体内实验中确定能够克服EGFR抑制剂耐药性的药物具有重要意义。
突变率在肺腺癌中约为22%-25%,在肺鳞癌中约为7%;吸烟状态会影响KRAS的突变率;KRAS 突变是一个弱预后因素。
目前,KRAS 突变状态不能用于任何治疗计划的患者选择。正在为 RAS 和 RAF 开发的药物包括索拉非尼和。
与肺腺癌患者诊断时年龄低、不吸烟、肝转移有关,与性别、分期、脑转移无关。ALK融合率在肺腺癌中约为9.6%。
ALK抑制剂是目前临床试验证实该药对ALK融合患者有良好疗效。
它通常在肺癌中高度表达。MET/HGF 信号轴与肿瘤细胞的多种生物学功能有关,包括其增殖、存活、迁移和侵袭。它也是肿瘤血管生成的重要因素;MET激活可能与化疗和放疗耐药有关,也可能与其他靶向药物耐药有关。
MET在肺癌中有时会发生突变和/或扩增,其扩增率在肺腺癌中约为4.1%。与年龄、性别、分期、吸烟状况、脑或肝转移无关。它是很多肿瘤,包括不良预后因素。因此,MET是肺癌中一个很有前景的新分子靶点,基于MET特点的临床试验设计将至关重要。MET扩增抑制剂包括ARQ-917等。目前,迫切需要临床试验来确定疗效好的药物的生物学特性。
除了上述EGFR、KRAS、ALK、MET靶向药物外,还有一些分子靶向药物在研究中,如曲妥珠单抗、拉帕替尼等用于HER2突变或扩增的分子靶向药物。PI3K突变体或扩增GDC-0941、XL-147、XL-765、PX-866、BEZ-235等,用于扩增,等等。这些药物需要进一步研究。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话