欢迎光临吉康旅!
说到最近最火的电视剧,一定是《乘风破浪的姐姐》。30位成熟的姐妹级演员在舞台上真的很迷人。虽然她已经不是十几二十几岁的小花,但姐姐们的故事感和掌控感才是真正吸引大家的地方。
不要误会我的意思,奇点蛋糕还没有准备好转变成娱乐。之所以提到姐妹,是因为她们在很多疾病的治疗中也有这样的存在。作为姐妹级疗法,她们的“出道”时间不算短,在很多疾病中都证明了自己,但同时,她们还在做其他尝试,为自己赋予更多价值。
在肿瘤治疗中,有很多这样的“姐妹”。1971年,美国科学家提出阻断血管的形成是抑制肿瘤生长的有效策略[1]。因为肿瘤从萌芽期开始生长需要氧气和营养,这些都是由血液提供的。在此背景下,出现了新的疗法和抗血管生成药物。
2004年,首个抗血管生成药物阿瓦斯汀(贝伐珠单抗)获FDA批准上市,正式拉开了肿瘤抗血管治疗的帷幕。
联合化疗,机制给出多种可能
时至今日,十多年来,抗血管生成药物不仅是单独治疗,还开发了与化疗等其他疗法的联合治疗。两人可以说是很好的一对。从力学的角度来看,这种组合具有许多增强功效的可能性。
首先,与正常组织相比,肿瘤内的血管在肿瘤内常表现为扩张、盘绕、盘绕、扭曲,血管壁有缝隙,导致渗漏,血液比正常血液更粘稠。船只。阻力更大。当这些条件加在一起时,更不用说化疗药物无法进入肿瘤[2]。甚至肿瘤自行生长所需的氧气和营养物质也是稀缺的。因此,整个肿瘤微环境处于酸性和缺氧状态。
正常组织(A)与肿瘤(B)血管系统对比
这不是“我杀了自己”吗?虽然这是真的,但事实并不那么乐观,更何况肿瘤会改变部分能量代谢来“打破游戏”,即使营养缺乏导致某些细胞的细胞周期停滞,也让它们变得更强抵抗化疗药物的能力,毕竟细胞分裂得越多,对化疗药物越敏感。
因此,抗血管生成药物的使用抑制了肿瘤复杂血管网络的形成,使其结构和血流更接近正常组织,改善了一些营养物质和氧气的供应。一方面,它允许肿瘤继续生长,从而恢复其对化疗药物的敏感性[3];另一方面,它改变了典型的酸性和缺氧免疫抑制环境,减少了免疫抑制细胞的数量,并恢复了一部分。免疫反应。
同时,一些化疗药物还能杀死骨髓来源的抑制性细胞,削弱免疫抑制。因此,从这个角度来看,化疗+抗血管生成药物仍然是增强免疫战斗力的强效组合[4]。
此外,肿瘤微环境得到改善,正常血管的“上升”也会带来好处,降低肿瘤间质液的压力。
肿瘤基质由结缔组织(胶原蛋白和弹性蛋白)、血管和一些淋巴管组成,在支持肿瘤和营养支持方面起着重要作用。间质液在间质内穿梭分布。与正常组织相比,肿瘤组织间液压力较高,会对血管造成压力,这也是导致血流量减少的原因。正常血管的“上升”可以反向抑制肿瘤间质液,降低间质液压力,自然增加氧气和化疗药物的输送[5]。
除了血管和肿瘤微环境的变化,抗血管生成药物和化疗也可能从另外两个方面引发火花。一是抑制促进血管生成的内皮祖细胞的增殖[6],二是在连续化疗之间抑制肿瘤细胞的增殖[7]。
图片来自:
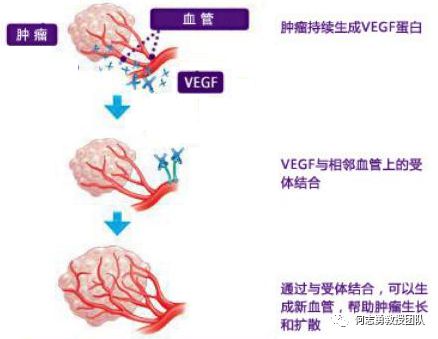
一些化疗药物,如紫杉醇和 5-氟尿嘧啶,可引起骨髓内皮祖细胞大量增殖,同时大剂量杀死肿瘤细胞。内皮祖细胞是血管内皮细胞的前体细胞。在收到“组织严重损伤!”的信号后,它们在骨髓中增殖,然后转移到外周血,在那里迁移到组织中,参与血管修复和血管生成。.
因此,通过在化疗的基础上加入抗血管生成药物来阻止内皮祖细胞的拯救,化疗的效果可以更好、更持久。
持续化疗一般是指“剂量密集型化疗”,它来自诺顿-西蒙假说。该假说认为,一个肿瘤内的肿瘤细胞并非都处于快速增殖期,有的处于静止期,对化疗不敏感。化疗药物杀死快速增殖的细胞后,它们会“苏醒”,在两次常规化疗之间的间隔内开始增殖。因此,可以通过缩短化疗间隔来达到最大的杀伤效果。
此外,血管生成是肿瘤生长的决定因素。因此,在化疗间隔期插入抗血管生成治疗,可以最大程度地抑制肿瘤增殖,取得比单独治疗更好的效果。
临床实践证实了真正的好处
说了这么多,理论上的可行性肯定是不够的。在实践中真正看到临床益处是硬道理。
以贝伐单抗为例。正如我们前面所说,2004年贝伐单抗获批上市,其获批正是基于此次III期临床试验的成功。共有800多名未经治疗的转移性结直肠癌患者入组,随机分为两组,分别接受标准化疗方案联合贝伐珠单抗或联合安慰剂。
结果显示,贝伐珠单抗组患者的中位总生存期为20.3个月,中位无进展生存期为10.6个月,较安慰剂组有所增加。4.7个月和4.4个月,患者的死亡风险降低了34%。本试验明确,对于转移性结直肠癌患者的一线治疗,在化疗中加入贝伐珠单抗与单独化疗相比,可显着延长患者的无进展生存期和总生存期[8]。
之后,贝伐单抗联合化疗也在另一项大型III期临床试验中得到证实。与单纯化疗相比,接受贝伐珠单抗联合化疗的一线和二线转移性结直肠癌患者在生存方面也有明显获益,疾病恶化或死亡风险降低1/3以上[9] .
单独化疗(蓝色)和联合治疗(红色)的总生存期比较
这也让贝伐珠单抗联合化疗获批新适应症,即联合疗法可作为转移性结直肠癌的一线治疗,随着病情恶化可继续接受贝伐珠单抗联合其他化疗药物. 二线治疗。
此外,根据试验结果,一线治疗后使用贝伐单抗联合化疗进行维持治疗,与不用药的维持治疗相比,可延长患者的生存期。
另一项试验结果显示,对于不能手术的转移性结直肠癌患者,采用三药化疗()联合贝伐珠单抗作为一线治疗和疾病进展后的二线治疗具有良好的生存期效益,中位总生存时间超过 2 年。同时,对于不能手术的患者,实现了更高的手术切除率。
这说明在研究较多的肠癌领域,抗血管生成药物联合化疗可以给患者带来比单独化疗更高的生存获益,从一线到二线治疗,作为治疗后的维持治疗还可以帮助控制病情的发展,可以说是全程“护航”。
除肠癌外,卵巢癌和非小细胞肺癌均采用联合疗法,尤其是卵巢癌。在抗血管生成药物出现之前,卵巢癌患者可以选择的新疗法很少。它依赖于反复化疗,贝伐珠单抗联合化疗显着提高了患者的无进展生存期。这也促使贝伐单抗自2011年起获批用于晚期卵巢的联合方案。癌症患者或复发后的一线治疗也是除化疗外,第一个获批用于此类患者的新疗法。
联合免疫治疗,未来潜力巨大
事实上,除了化疗,免疫疗法和抗血管生成药物之间并没有重叠,它们是当今癌症治疗的“破坏者”。

首先,Fas配体存在于肿瘤的血管系统中,其表达与肿瘤微环境中杀伤性T细胞的减少和调节性T细胞的增多有关。也就是说,Fas配体的存在构建了一个免疫抑制微环境,Fas配体的表达受血管内皮因子A、白细胞介素10和前列腺素E2的诱导[10]。
你见过熟人吗?是的,VEGF,其实在此之前,VEGF一直被认为是一种关键的免疫抑制分子。
一方面作用于肿瘤的血管系统,降低内皮细胞粘附分子的表达。粘附分子是一类介导细胞与细胞或细胞与细胞外基质接触的分子。它在这些事情中扮演着重要的角色。因此,粘附分子的减少会导致内皮细胞无法识别白细胞并将其拒之门外。白细胞含有可以杀死肿瘤的 T 细胞,肿瘤成功地逃避了免疫系统的制裁。
另一方面,VEGF也直接影响T细胞。大家都知道免疫检查点PD-1会抑制杀伤性T细胞的免疫功能,因此研究人员开发了免疫检查点抑制剂。但你可能不知道的是,VEGF其实与杀伤性T细胞上PD-1表达增加有关[11],这也是其免疫抑制功能的“秘密”之一。
除了杀伤性T细胞外,VEGF还可以抑制树突状细胞的分化和活性[12],提高抑制免疫反应的调节性T细胞和髓系抑制细胞的水平[13,14]。树突状细胞负责抗原呈递,即帮助T细胞识别肿瘤细胞。这可以说是全方位打乱了免疫系统,让肿瘤逍遥法外。
树突状细胞(图片来自:)
这些“罪名”都暗示,在免疫检查点抑制剂中加入抗血管生成疗法,或许能够双重拯救免疫系统,获得更好的治疗效果。
尽管免疫检查点抑制剂上市较晚,但它们与抗血管生成疗法的结合也在多种癌症中进行了尝试,例如卵巢癌。
80%的晚期卵巢癌患者在接受一线治疗期间或之后会复发。随着复发次数的增加,他们最终会对化疗产生耐药性。因此,如何延长一线治疗的复发间隔非常重要。
贝伐珠单抗在卵巢癌的一线治疗中显示出良好的疗效,抗血管生成药物与免疫治疗有一定的协同作用。基于此,化疗联合贝伐珠单抗联合PD-L1抑制剂的研究诞生了,其目前的探索方向是针对新诊断的晚期卵巢癌患者[15]。
该试验于2017年开始,是第一个评估该药物组合对晚期卵巢癌患者无进展生存期和总生存期影响的III期随机对照临床试验。它将在今年的欧洲肿瘤学会年会上发表最新研究成果。
此外,对于不能手术的肝癌患者,PD-L1抑制剂联合贝伐珠单抗也取得了不错的效果。与常用的一线治疗药物索拉非尼相比,其无进展生存期和12个月生存率均显着提高,死亡风险降低42%[16]。
总的来说,人类抗肿瘤药物治疗迄今经历了三个时代,化疗时代-靶向治疗时代-免疫治疗时代。与此同时,目前三类药物的联合治疗也乘风破浪,风头正盛,尤其是以贝伐单抗为代表的抗血管生成药物,以及化疗、免疫治疗、小分子酪氨酸激酶抑制剂( TKI)。不同肿瘤类型的联合使用有突破。
无论是机制还是临床试验结果都证实,在保证安全的前提下,联合治疗的疗效优于单药治疗,也得到了指南的推荐。相信未来会以抗血管生成疗法为基础的联合疗法。在更多的患者群体中有更广泛的应用。
参考资料:
[1] J.: [J]. 新的, 1971, 285(21): 1182-1186.
[2] AI, I F. Drug in [J]., 2006, 6(8): 583-592.
[3] O、CM、K 等。药物与[J].其中, 2007, 99(19): 1441-1454.
[4] C、L、M 等。的由和反[J]., 2015, 64(1): 83-89.
[5] Jain R K. with anti-: a new for .[J]., 2001, 7(9): 987-989.
[6] Y, E, JM, et al.-cell: for as [J]. 细胞, 2008, 14(3): 263-273.
[7] C A. of [J]., 2005, 19(4): 26-31.
[8] H、L、W 等。加,, 并为[J]. 2004 年新的 350(23): 2335-2342.
[9] J、J、D 等。in(): a 3 .[J]., 2013, 14(1): 29-37.
[10] Motz GT, SP, Wang L, et al. FasL a in [J]., 2014, 20(6): 607-615.
[11] T、O、E 等。VEGF-A对CD8+T的影响[J]., 2015, 212(2): 139-148.
[12] DI、T、T 等。In Vivo[J]., 1998, 92(11): 4150-4166.
[13] M, S, E, et al.--T-cell in [J]., 2013, 73(2): 539-549.
[14] Y, Chen X, MM, et al. VEGF与-1和-2的关系[J]., 2007, 110(2): 624-631.
[15] KN, S. in: /GOG 3015/-OV39. A III, of in with, and to with-III or IV, tube, or [J]. 的, 2019, 29( 2).
[16] S 芬恩等人。加在[J]. 新, 2020, 382(20): 1894-1905.
封面图片来自
本文作者 | 应玉燕
特别声明:以上内容(包括图片或视频,如有)由自媒体平台“网易”用户上传发布。本平台仅提供信息存储服务。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话