欢迎光临吉康旅!
连续给药可提高具有常见突变的黑色素瘤患者的无进展生存期。…
实体瘤的生长通常是由关键原癌基因的突变驱动的。在非小细胞肺癌()中,KRAS(RAt肉瘤病毒)基因的体细胞突变将其转化为癌基因,使肿瘤对厄洛替尼()或吉非替尼()等常见化疗产生耐药性。
以前,KRAS 被认为是“不可下药的”,因为这种微小蛋白质的表面缺乏与潜在小分子抑制剂相互作用的深袋。由于许多突变 KRAS 依赖于组成型激活,研究人员继续探索 KRAS 及其下游信号通路作为可能的目标。这项研究终于开始得到回报。在更大的 KRAS 生态系统的背景下,共同接受针对肺癌的免疫自我防御的补充方法现在已经完全出现。
他们一起充实了肿瘤生物学的治疗缩影,可以复制和修改作为治疗多种癌症类型的蓝图,每种癌症都由其独特的致癌驱动因素维持。在 Cell 的一篇文章中,研究人员概述了对抗 KRAS 依赖的四种方法:免疫检查点抑制剂、KRAS 新抗原靶向、直接 KRAS 抑制剂和 KRAS 信号抑制剂。
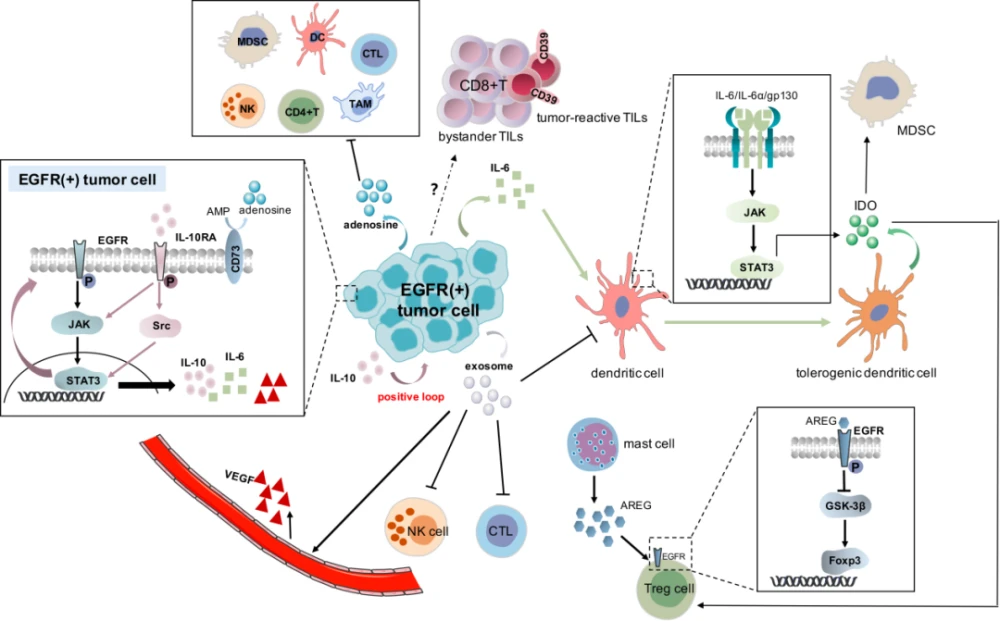
免疫检查点抑制剂 (ICI) 已成为许多癌症的标准治疗方法。PD-L1(程序性细胞死亡配体1) 表达与 KRAS 细胞系和患者肿瘤组织中的 KRAS 特异性改变有关。肿瘤经常过度表达 PD-L1; ( ),单独或与常见的抑制剂联合使用) KRAS 变异体,可能是有益的。例如,对 G12C 变异体具有特异性的抑制剂可促进促炎性肿瘤微环境,当与 ICIs 一起使用时,这种微环境会产生长期的 T 细胞肿瘤反应,当药物被管理。
KRAS 突变,例如 G12C,可以产生新的表位,免疫系统可以将其识别为外源蛋白。由于免疫系统从未接受过 KRAS 版本的训练,后者只是后来在癌细胞中发生突变,因此它们将被视为应该受到攻击的新抗原。问题是,当检测到肿瘤时,免疫系统通常需要一点帮助。免疫疗法的目标是通过疫苗接种或通过过继性 T 细胞疗法引发对这些新抗原的直接 T 细胞反应,其中细胞被外部教育、扩增和重新引入。默克公司已经开展了针对 KRAS G12C、G12D、G13D 和 G12V 的 mRNA 癌症疫苗试验。疫苗编码为单个 RNA 分子新抗原多联体,应在 HLA-A11:01 和/或 HLA-C*08 上最佳呈现:
我们已经在上面看到了突变 KRAS 的直接抑制剂如何有效,尤其是与 ICI 一起使用时。主要好处是细胞的非突变野生型 KRAS 不应受到药物的影响,从而减少副作用。针对 KRAS 的另一种策略利用了这样一个事实,即它通过特定氨基酸侧链的法尼基化定位于质膜来发挥作用。不幸的是,到目前为止,法尼基转移酶抑制剂在临床试验中的结果很差。同样,旨在阻断 GTP-KRAS 相互作用的小分子抑制剂也失败了,这主要是由于 GTP 对 KRAS 的高亲和力。或者,现在已经开发出泛 KRAS 抑制剂,例如 BBP-454 ( ),它可以与以前无法识别的结合口袋结合。另一种泛 KRAS 抑制剂 BI 会干扰 KRAS 与 SOS1 的结合,
通过与非小细胞肺癌中的 KRAS 信号传导机制有关的合成致死筛选已确定了几个基因。这些包括 TANK 结合激酶 1(TBK1)、细胞周期蛋白依赖性激酶 4(CDK4) 和超大 B 细胞淋巴瘤 (BCL-XL))。使用曲美替尼 (MEK1/2) 进行抑制( BCL-XL/BCL-2 抑制剂)靶向它们的表达导致异种移植模型中显着的细胞凋亡和肿瘤消退。KRAS 信号传导还通过激活脂肪生成和 ERK2 激酶活性来诱导脂肪酸合成。在 KRAS 突变中用 抑制脂肪酸合酶肺腺癌细胞系显示细胞生长明显减少。
患者对化疗的完全反应取决于 KRAS 以外基因中是否存在变异。例如,具有 EGFR(表皮生长因子受体)突变的患者对厄洛替尼的反应率为 60%。从某种意义上说,KRAS 突变和 EGFR 突变似乎是相互排斥的。KRAS 突变阳性但没有 EGFR 突变的肺癌患者对化疗的反应较差。由于 KRAS 的完整突变景观现在正在迅速出现,有效的治疗可能涉及直接 KRAS 靶向和通过下游效应器的合成致死性间接靶向的组合方法。当两个或多个基因表达缺陷的组合导致细胞死亡时,就会发生合成致死性,而这些基因中只有一个的缺陷不会导致细胞死亡。突变,
NTRK 融合肿瘤中的拉罗替尼:数据不足......
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话