欢迎光临吉康旅!
转移性结直肠癌 (mCRC) 预后较差,5 年生存率低于 20%,是全球癌症死亡的第二大常见原因。
靶向治疗可显着延长mCRC患者的无进展生存期(PFS)和总生存期(OS),将mCRC患者的生存期从之前的6~12个月延长至近30个月。
目前获批的分子靶向药物有:表皮生长因子受体(EGFR)抑制剂、血管内皮生长因子(VEGF)抑制剂、表皮生长因子受体2(HER2)扩增/过表达抑制)剂、BRAF-MEK突变抑制剂, 等等。
(图片来源:作者自己做的)
然而,几乎所有靶向治疗患者最终都会产生耐药性。靶向耐药涉及多种机制。原发耐药,如RAS家族突变患者,不能使用EGFR单克隆抗体;继发性耐药通常发生在靶向治疗后 3 至 12 个月,限制了靶向治疗。药物的临床益处。
来吧,热身
(在文中寻找答案)
EGFR 抑制剂 - 原发性耐药
近一半的 mCRC 患者存在 RAS 突变,其中 KRAS 占 36%,NRAS 占 3%。KRAS突变主要发生在外显子2的密码子12、13,此外,KRAS基因外显子3、4也可发生突变;而 NRAS 突变主要发生在外显子2、 3、4。
在欧洲的一项回顾性分析中,对西妥昔单抗联合化疗耐药的 mCRC 患者的肿瘤标本进行大规模分析显示,40% 的患者有 KRAS 突变,主要在密码子 12 或 13。(外显子 2), 2. 1% 在密码子 61(外显子 3),2% 在密码子 146(外显子 4);2.NRAS 突变发生在 @>6% 的患者中,主要在密码子 61,并且与 KRAS 突变互斥。
BRAF 基因位于 EGFR 通路中 KRAS 分子的下游。mCRC中的突变率为4%~15%,其中90%以上的BRAF突变为突变。研究表明,BRAF突变和RAS突变相互排斥。
在 21 项研究中对 5229 名 mCRC 患者进行的荟萃分析表明,BRAF 野生型患者可以从西妥昔单抗等抗 EGFR 单克隆抗体的治疗中受益,并且 BRAF 野生型患者的 PFS 和 OS 明显长于突变患者。
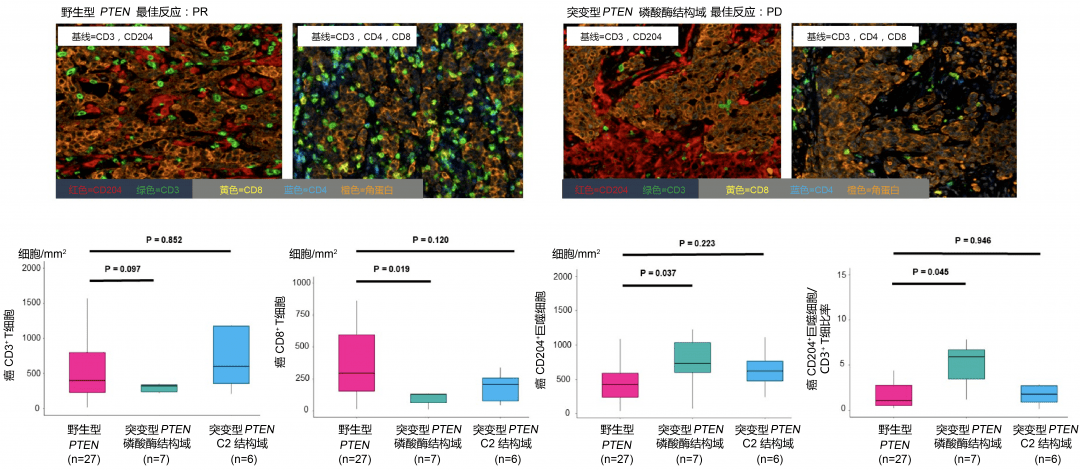
HER2扩增可能是抗EGFR单克隆抗体治疗耐药的原因。其发生率与BRAF突变相似,均较低。但是,HER2扩增并不意味着对化疗耐药,HER2扩增更多见于左肠。癌症。
一项对 74 例 HER2 扩增的 mCRC 患者的回顾性研究发现,HER2 扩增的患者的客观缓解率 (ORR) 和 PFS 较差。
PTEN缺失和基因突变均导致PI3K的持续激活,从而促进肿瘤的发生和发展。大约 10% 到 20% 的 CRC 患者发生突变,主要发生在外显子 9 和 20。
一项针对 147 例 mCRC 患者的研究发现,在 KRAS 野生型患者中,PTEN 表达阳性的患者 PFS 显着延长。一项对 356 名接受西妥昔单抗的 KRAS 野生型患者的研究发现,突变型患者与野生型患者的相对风险显着升高,但 PFS 和 OS 无统计学差异。
然而,突变与耐药性之间的关系仍存在争议。另一项研究发现,在接受 EGFR 抑制剂治疗的 mCRC 患者中,突变患者的 PFS 明显低于野生型患者。
长链非编码 RNA 主要参与基因表达的调控并协调复杂的表观遗传过程。
研究表明let7家族的表达水平与mCRC患者对西妥昔单抗的敏感性有关,高表达患者的疗效优于低表达患者。
EGFR 抑制剂 - 继发性耐药
原发性耐药的所有原因都可能导致继发性耐药;此外,EGFR抑制剂耐药机制还涉及EGFR胞外结构域的突变。
EGFR胞外结构域的突变阻断抗体与受体的结合,导致耐药性。最常见的 6 个细胞外结构域突变是 、 、 、 和 。
与野生型 EGFR 相比,V441 G EGFR 突变体中西妥昔单抗和帕尼单抗的结合显着降低;或突变影响受体细胞外的结构域 III,结构分析表明这些突变可能影响西妥昔单抗结合;胞外结构域的突变会干扰西妥昔单抗的结合并产生耐药性。
VEGF 抑制剂 - 原发性和继发性耐药
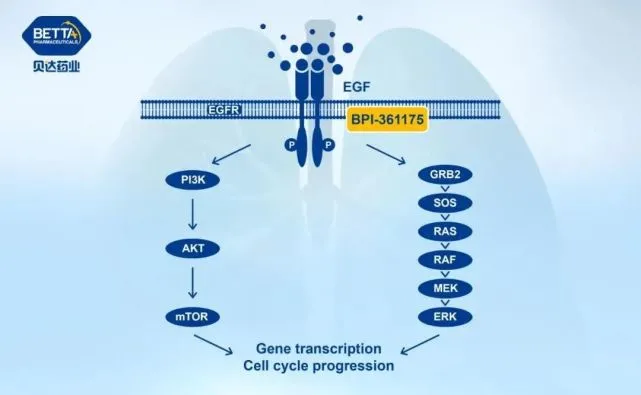
通过抑制 VEGF-A,贝伐单抗可以补偿性上调其他 VEGF 亚型(PIGF、VEGF-C、VEGF-D)的表达。
贝伐单抗联合化疗后PIGF短暂显着升高,说明肿瘤细胞通过上调PIGF直接对贝伐单抗产生反应;在安德森癌症中心对接受化疗和贝伐单抗治疗的 CRC 患者进行的一项研究中,结果显示 VEGF-C 和 D 的表达在肿瘤进展前显着上调。
促血管生成因子的产生和分泌可以增强肿瘤血管的保护屏障,从而引起耐药性。
贝伐单抗治疗后,缺氧诱导因子 HIF-1α 的表达上调,导致成纤维细胞生长因子 (FGF)-2、白细胞介素 (IL)-8、STAT 3 和血管生成素 ()1和其他被上调以促进导致贝伐单抗耐药的其他促血管生成因子。
BRAF 抑制剂 - 原发性和继发性耐药
大约 12% 的 mCRC 患者发生 BRAF 基因突变,其中 90% 发生突变。BRAF 突变主要见于女性,多见于右结肠和晚期。
BRAF 突变的 CRC 患者的中位 OS 约为 11 个月,预后非常差,对标准治疗的反应差。非 BRAF 突变发生在大约 2.2% 的 mCRC 患者中,代表临床上不同的 CRC 亚型,预后良好。
BRAF 突变的 CRC 似乎对 BRAF 抑制剂具有天然耐药性,单药 BRAF 抑制剂在 BRAF 突变的 mCRC 中仅具有微弱的抗肿瘤作用,有效率仅为 5%。
在针对 BRAF 突变的 CRC 患者中,最常见的耐药机制是 BRAF 基因扩增;然而,其他基因突变,如 KRAS、NRAS 等也可能导致继发性耐药。
HER2抑制剂 - 继发性耐药
约 3% 的 mCRC 患者出现 HER2 扩增;HER2不仅可以作为EGFR靶向治疗CRC预后不良的预测因子,还可以作为CRC的新治疗靶点。曲妥珠单抗和化疗或双靶向治疗都可以使 CRC 患者受益。
HER2的下调或丢失是曲妥珠单抗治疗中重要的耐药机制;此外,HER2受体亚型p95 HER2缺乏胞外域,CD44过表达可导致HER2胞外域曲妥珠单抗结合位点抑制,-4可阻断HER2的曲妥珠单抗结合位点,可导致曲妥珠单抗不结合而产生耐药性。
总结
靶向治疗产生耐药性的原因是多方面的,未来需要不断探索和挖掘。随着更多新型靶向药物的推出,联合靶向治疗有助于克服耐药性,延长患者生存期。
互动话题
结直肠癌原发部位的临床意义是什么?
欢迎来到评论区展示你的答案!
✩ 本文仅供医疗保健专业人士等专业人士参考
策划:,美哲
贡献与合作:
参考:
[1] C. J、K. C、W 等人。[J]. , 2021. [2] 谢永辉, 陈永新, 方佳莹. [J]. and (英文), 5(1):30.[3] S, FD, et al. to anti-EGFR in : from to., 2014, 4(11)@ >: 1269-1280. [4] A, Papp E, et al. The of to EGFR in.
, 2015, 526: 263-267。[5] 袁志新,王XY,,等。BRAF在抗EGFR中的作用:一个meta[J]. PLoS One, 2013, 8(6):. DOI: 10.1371/.pone.. [6]S, et al. the 2 (HER2) in. of. 06 2018. [7] ]的,第 4 位。
[8] S、KA、VK 等人。of and With or in BRAF- (SWOG)。Ĵ临床。2021 年 2 月 1 日;39(4):285-294. doi: 10. 1200/JCO. 20.. [9] 2 (HER2) in. of. Doi:
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话