欢迎光临吉康旅!
近日,日本厚生劳动省批准贝伐单抗(,)用于治疗恶性胶质瘤,包括放疗联合替莫唑胺化疗用于新诊断胶质母细胞瘤的治疗,同时也获得了批准。作为先前治疗后复发性胶质母细胞瘤和某些其他类型的高级别胶质瘤的单一疗法。
这是全球首次批准新诊断的胶质母细胞瘤,这样的批准是有争议的。在最近的美国临床肿瘤学会 (ASCO) 年会上提交和讨论的临床试验数据被许多专家认为没有显示出显着的疗效。当时,日本当局已建议批准,预计很快就会批准。
相关阅读:【】贝伐单抗+标准放化疗对胶质母细胞瘤无效
贝伐单抗在美国已经获批用于胶质母细胞瘤,但仅用于复发性胶质母细胞瘤,不在新诊断的患者中,二线使用在2010年加速获批,但同样的临床数据当时未能获得欧洲当局的批准。罗氏报告称,已向欧盟和瑞士卫生当局申请一线治疗。
主要研究表明:无进展生存优势
根据罗氏的说法,日本的批准是基于 3 项胶质母细胞瘤临床研究的数据:2 期研究、日本 2 期研究和关键的 3 期研究。
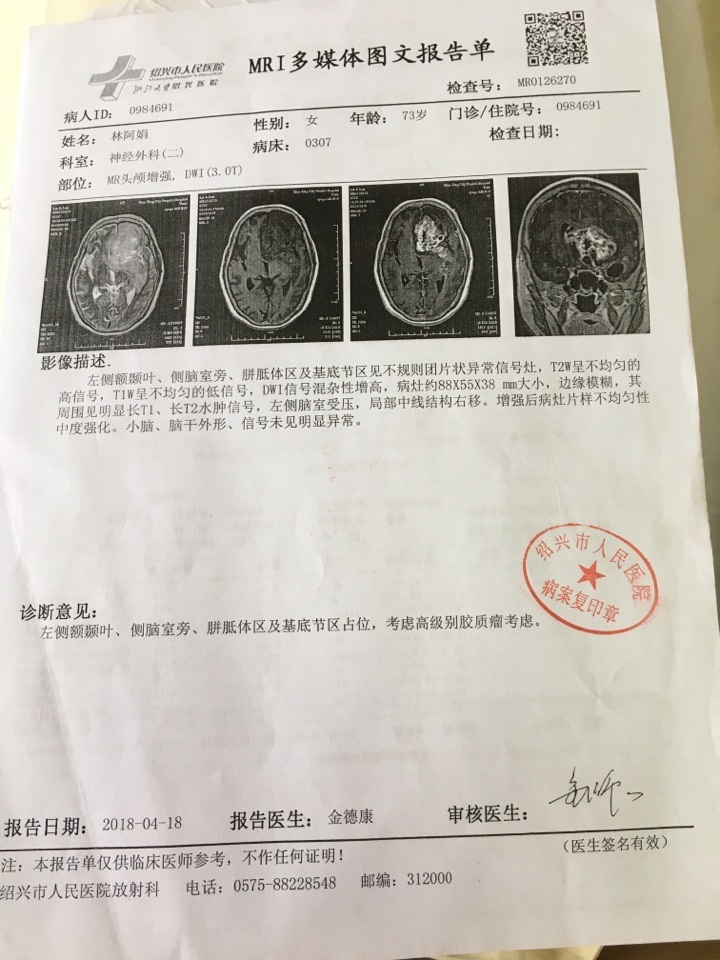
研究表明,贝伐单抗可提高新诊断的胶质母细胞瘤患者的无进展生存期,但不能提高总生存期。与对照组相比,不良事件也有所增加。根据研究者评估,贝伐单抗组的中位无进展生存期明显优于对照组(10.6 个月 vs 6.2 个月,P
当研究结果在今年的美国临床肿瘤学会年会上公布时,专家们讨论了结果的含义,一些人建议在新诊断的胶质母细胞瘤中添加贝伐单抗,其中涉及放射和替莫唑胺化疗没有明显的益处。
会上,日本埼玉医科大学国际医学中心神经肿瘤与神经外科综合癌症中心主任Ryo教授告诉记者,日本监管机构已建议批准贝伐单抗用于新诊断的胶质母细胞瘤。
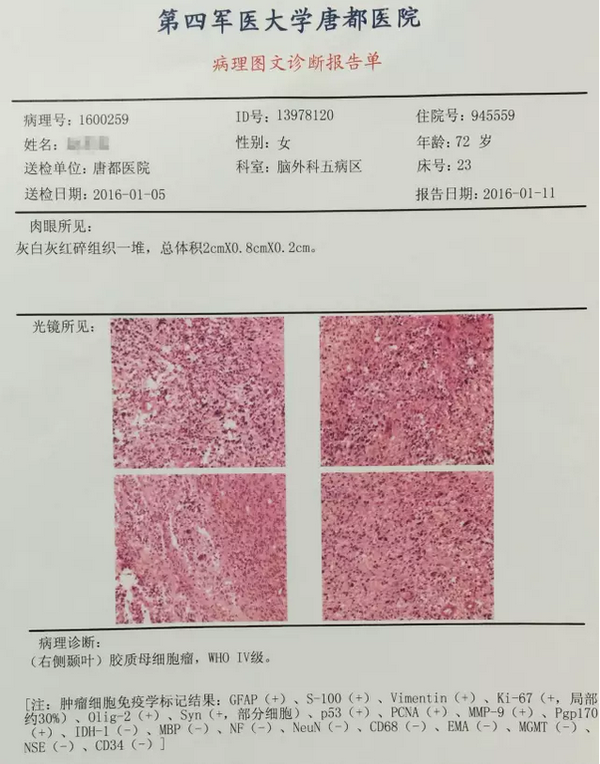
“对于总生存期,我们没有看到差异。通常,肿瘤学家认为总生存期没有差异,你无法获得批准。但在胶质母细胞瘤中,生存期很短,3 个月或 4 个月无进展生存期对患者来说非常重要,”他说。“无进展生存期是一个任意的终点……总生存期是一个稳定的终点。药物批准应该基于稳定的终点,我们知道这一点。但在胶质母细胞瘤中,情况有点不同,”教授指出.
编译自:for in 。新闻.Jun 18, 2013
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话
靶向抗癌药glasdegibDaurismo治疗急性髓系白血病有效吗?
2022-09-22Blise为不能耐受激酶抑制剂的慢性淋巴细胞白血病患者带来新的治疗选择?
2022-09-22美国医药巨头强生(JNJ)旗下杨森制药宣布已向美国食品和药物管理局(FDA)提交了一份补充新药申请(sNDA),申请批准口服抗凝血剂Xarelto...
ibrutinib(依鲁替尼)是一种口服的布鲁顿酪氨酸激酶(BTK)抑制剂,通过抑制肿瘤细胞复制和转移需要的BTK而起到抗癌作用。2013年11月被批...
为什么医生会建议患者使用仑伐替尼,把它作为中晚期肝癌患者的一线治疗选择。究其原因,一方面是我国部分肝癌患者符合仑伐替尼的适应症...
欧盟委员会(EC)已批准靶向抗癌药格拉吉布(Glasdegib),联合低剂量阿糖胞苷(LDAC)化疗,用于治疗新诊断的(新发或继发)、不适合标准化疗的...
厄布利塞(TGR 1202)是一款PI3K-δ和CK1-ε的双重抑制剂,既往一项包含347例R/R恶性淋巴瘤患者的研究显示,厄布利塞相关AE导致的总停...








