欢迎光临吉康旅!
2020年5月30日,美国FDA批准PD-L1免疫抑制剂联合贝伐单抗(“T+A”联合疗法)用于之前未接受过全身治疗的不可切除肝细胞。癌症患者。
2020年10月28日,中国国家药品监督管理局(NMPA)批准其创新的肿瘤免疫治疗药物阿特珠单抗联合贝伐单抗用于治疗以前未接受过全身治疗的不可切除的肝细胞癌(HCC)。)病人。
2021年1月12日,在本月即将召开的美国临床肿瘤学会胃肠肿瘤学研讨会(ASCO GI)上,正式报道其PD-L1抑制剂阿特珠单抗联合贝伐单抗,在一线更新总生存期(OS)来自晚期肝癌患者的 III 期临床试验的结果。
是一种与 PD-L1 结合并阻断其与 PD-1 受体相互作用的单克隆抗体。通过抑制PD-L1,它可以激活T细胞来破坏肿瘤细胞。
产品名称:(特山旗)
通用名称:(/)
美国首次批准:2016 年 5 月
中国首次获批:2020年2月

批准适应症:三阴性乳腺癌、尿路上皮癌、非小细胞肺癌、小细胞肺癌(中国)、肝癌(中国)
肝癌的推荐剂量:每 3 周在 60 分钟内静脉注射 1200 mg,然后在同一天给予 15 mg/kg 贝伐单抗,直至疾病进展或出现不可接受的毒性。
贝伐单抗是一种单克隆抗体,可与VEGF结合,阻止VEGF与内皮细胞表面受体相互作用,从而抑制内皮细胞增殖和新血管生成,导致肿瘤组织血氧供应不足,延缓肿瘤生长。和转移,最终发挥抗肿瘤作用。
商品名:(阿维他林)
通用名称:(贝伐单抗)
目标:VEGF
首次获得美国批准:2004 年
中国首次获批:2015年
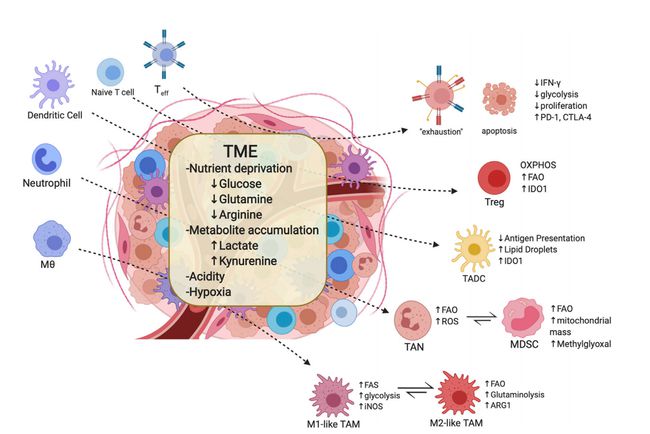
批准适应症:结直肠癌(中国)、肾癌、卵巢癌、肺癌(中国)、肝癌(中国)
肝癌的推荐剂量:15 mg/kg 贝伐单抗,联合 1200 mg ,每 3 周静脉注射一次,每次超过 60 分钟。
临床数据
一项全球 III 期、多中心、开放标签研究,旨在评估“T+A”方案与索拉非尼对既往未接受过全身治疗的不可切除肝细胞癌 (HCC) 患者的疗效。
在这项研究中,共有 501 名既往未接受过全身治疗的不可切除 HCC 患者被纳入,并以 2:1 的比例随机分配接受“T+A”方案(n=336 患者)或单药治疗索拉非尼(n=165 例)治疗。
参加本研究的患者必须患有局部晚期或转移性和/或不可切除的 HCC,而之前没有任何全身治疗;1 个或多个可测量的病灶;ECOG评分0到1;肝功能 - Pugh A 级。
最新研究结果显示,中位随访时间为15.6个月,“T+A”方案可使死亡风险降低34%。
“T+A”方案组的中位总生存期(OS)(n=336) vs 索拉非尼组(n=165) 为 19.2 个月)VS 1 3.4 个月;中位无进展生存期 (PFS) 为 6.9 个月 vs 4.3 个月。
“T+A”方案组(n=326) vs 索拉非尼组(n=159))的客观缓解率(ORR)分别为 30% vs 11%;完全缓解(CR) 8% 对比
“T+A”方案组(n=97) VS 索拉非尼组(n=18))的中位缓解持续时间(DOR)为 18.1 个月 VS 1 4.9 个月。
在中国亚组中,“T+A”方案组(n=133) VS 索拉非尼组(n=61))的中位 OS 为 24 个月 VS 11.4个月。
安全性方面,与此前已知的单一用药安全性概况一致,未发现新的安全性信号。
图注:阿特珠单抗联合贝伐单抗一线治疗肝癌的临床数据
概括
该研究中方首席研究员、中国临床肿瘤学会(CSCO)副理事长秦树奎教授指出,2020年10月,“T+A”联合免疫方案在中国正式获批,同时获得国内外众多权威机构的认可。临床指南列出了最佳证据级别和最高推荐级别的推荐疗法,充分证明了该联合疗法药物/方案的突破性意义。
值得一提的是,虽然试验和扩展试验中的中国亚组有较高的乙肝感染率、大血管侵犯/肝外转移、甲胎蛋白≥/ml等不良预后因素,但仍取得了较好的效果。优异的疗效,尤其是24.0个月的中位总生存期,实现了晚期肝癌治疗的新突破,对广大中国患者具有里程碑意义!
【重要提示】文中所有信息仅供参考,具体治疗请遵医嘱!
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话