欢迎光临吉康旅!
本文首发于 of 2017 年第 1 期
恶性脑水肿是恶性肿瘤患者的严重临床事件,可导致一系列神经系统症状和体征,如头晕、头痛、肢体运动障碍和认知功能改变等。常见的类型有放射性脑水肿和肿瘤性脑水肿。常见的缓解药物包括类固醇、甘露醇等脱水剂和利尿剂,但这些药物对严重脑水肿的作用有限。贝伐单抗是一种重组人源化单克隆IgG1抗体,与血管内皮生长因子(VEGF)结合,特异性阻断VEGF,与内皮细胞表面受体结合,减少内皮细胞增殖和新生,形成血管,降低血管通透性,抑制肿瘤生长,并被批准用于治疗各种实体瘤[1]。
1 脑水肿的形成及贝伐单抗治疗恶性脑水肿的作用机制
当辐射作用于血管时,血管内皮细胞发生纤维蛋白样变化,导致组织缺氧坏死,并释放出大量作用于血管的细胞因子如VEGF[2]。VEGF具有两个重要的生物学特性。一方面,作为血管衍生肽成分,导致渗透性血管生成和毛细血管扩张;病灶周围水肿[3]。此外,辐射可引起星形胶质细胞损伤,进一步释放VEGF,导致血脑屏障损伤和脑水肿进一步加重[4]。等[5]对7例放射性坏死患者的手术标本进行研究,发现放射性坏死周围区域有明显的薄壁浸润性血管生成。坏死区的主要细胞表型为胶质纤维酸性蛋白( , GFAP) 阳性星形胶质细胞和 CD68/阳性小胶质细胞。免疫组化结果显示,CD68/阳性细胞和GFAP阳性细胞分别表达缺氧诱导因子-1α(-1α,HIF-1α)和VEGF。HIF-1α 诱导 VEGF 增加,从而诱导渗透性血管生成,导致辐射诱导的脑水肿的形成。
肿瘤性脑水肿是指与中枢神经系统肿瘤相关的肿瘤周围脑组织中水含量增加。通常,血脑屏障由穿过跨膜蛋白和细胞质蛋白的无孔毛细血管组成,如连接蛋白、封闭蛋白、ZO-1、ZO-2、ZO-3 和钙粘蛋白。整合。VEGF可与肿瘤VEGF受体结合,刺激肿瘤细胞的增殖和侵袭,导致紧密连接和ZO-1磷酸化,打开紧密连接,破坏血脑屏障、水、电解质和血浆蛋白。渗出,形成肿瘤性脑水肿。等[6]研究了101例脑膜瘤脑水肿患者,发现瘤周水肿指数与VEGF-A蛋白和VEGF基因表达呈正相关,脑膜瘤毛细血管长度与瘤周水肿呈正相关。研究表明,VEGF是脑膜瘤脑水肿形成的关键,而抗VEGF药物贝伐单抗可有效治疗肿瘤脑水肿。
放射性脑水肿和肿瘤性脑水肿的形成与VEGF密切相关。贝伐单抗是一种人源化抗VEGF单克隆抗体,与VEGF结合,阻止VEGF与内皮细胞表面受体结合,减少内皮细胞增殖和新生血管形成,降低血管通透性,缓解脑水肿。因此,贝伐单抗成为一种靶向治疗,以防止 VEGF 到达其目标毛细血管以逆转脑水肿。
2 贝伐单抗治疗放射性脑水肿的疗效
靶向VEGF及其受体的靶向药物越来越受到关注。大量临床研究证实,贝伐单抗可减少肿瘤血管生成,抑制肿瘤细胞增殖,减轻恶性脑水肿。
等[7]对2007年首次贝伐单抗治疗放射性坏死脑水肿患者进行了回顾性分析,结果显示,贝伐单抗治疗4个周期后,8例患者放射性脑水肿明显改善。MRI图像显示流体衰减反转恢复(ORR)序列上的高信号区域面积平均减少60%,患者每日地塞米松消耗量显着减少。研究人员认为,贝伐单抗降低了 VEGF 水平,使血脑屏障相对正常化,并显着减少了放射性脑水肿。2012年复旦大学附属华山医院报道了贝伐单抗治疗17例放射性脑坏死、伽玛刀放疗后脑水肿患者的临床研究结果。贝伐单抗治疗后,16例患者的临床神经症状明显改善,显示贝伐单抗显着减少放射性脑坏死和脑水肿[8]。Wang等[9]研究了贝伐单抗治疗射波刀放疗后脑转移伴广泛脑水肿患者的疗效和安全性。贝伐单抗在 10 天开始,持续至少 2 个周期。MRI影像结果显示肿瘤平均缩小55.8%,脑水肿体积平均缩小63.4%。7例患者临床症状明显好转,仅1例患者对治疗反应不佳,但地塞米松剂量也有所减少。该研究表明,射波刀治疗后早期辅助贝伐单抗治疗广泛脑水肿的脑转移患者是安全有效的。该研究假设在射波刀治疗之前应用贝伐单抗可以提高肿瘤氧合能力,并通过增加肿瘤放射敏感性来提高肿瘤治疗效果。在这种情况下,可以通过减少辐射剂量来避免严重的放射性脑水肿。沉等人。[10] 2015年报道,贝伐单抗治疗脑肿瘤二疗程放疗后出现严重放射性脑水肿的10例患者,经激素和甘露醇治疗无效。治疗第二天临床症状迅速缓解,生活质量明显改善。
上述临床研究表明,贝伐单抗治疗放射性脑水肿具有显着的临床疗效。但也有研究发现,贝伐单抗在复发性放射性脑水肿的二疗程治疗中仍有效。等[11]报道用贝伐单抗治疗放射性脑坏死和脑水肿2例。贝伐单抗治疗6个周期后,患者的神经认知功能和脑水肿明显改善。服药几个月后,放射性脑坏死、脑水肿再次复发,再次给予贝伐单抗也起到了与第一次治疗相似的作用,患者临床症状明显好转。
3 贝伐单抗治疗肿瘤性脑水肿的疗效
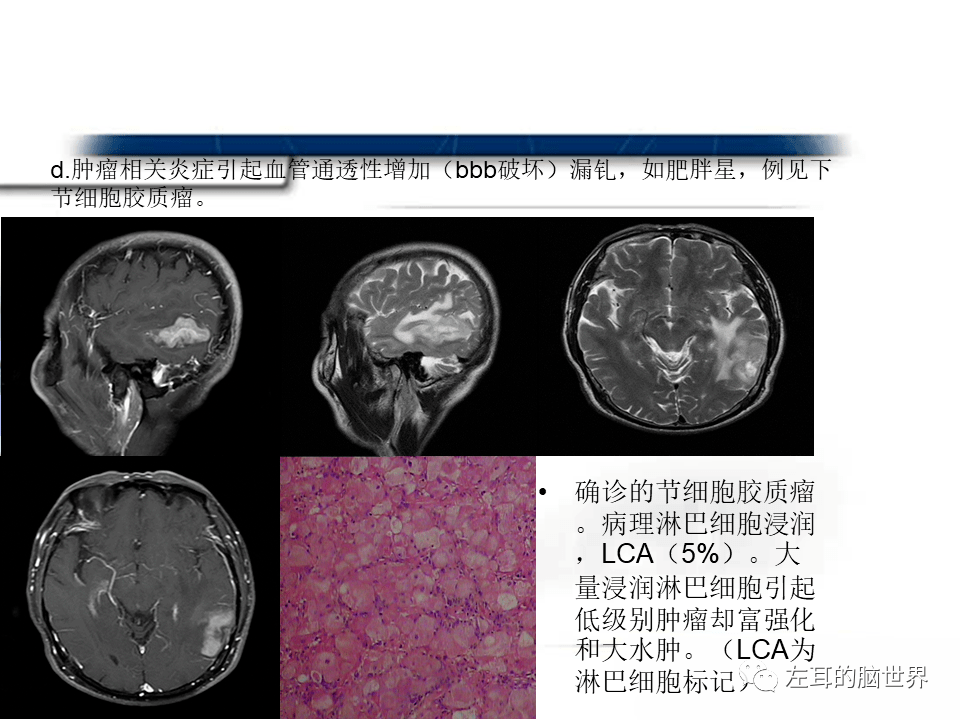
由于贝伐单抗作用于VEGF的特殊机制,对肿瘤脑水肿也有积极作用。国内外相关专家也对贝伐单抗在肿瘤脑水肿中的应用进行了一系列基础和临床研究。
在一项颅内接种人肺腺癌细胞的大鼠模型研究中,进行 MRI 以评估贝伐单抗和生理盐水治疗前后 1 天的肿瘤体积、游离水含量和血容量。通过测量14C-氨基异丁酸(14C-酸,AIB)在肿瘤和脑中的渗透性来评估小分子药物的渗透性。结果显示,与生理盐水组相比,贝伐单抗治疗组减缓了肿瘤生长,阻断了水肿的增加,并且没有改变肿瘤血容量,而贝伐单抗显着降低了肿瘤内的血管通透性和AIB。研究表明,在大鼠模型中,贝伐单抗部分恢复了血脑屏障的正常低通透性特征,并改善了肿瘤脑水肿[12]。
一项欧洲多中心回顾性研究分析了全身治疗(贝伐单抗、化疗、生长抑素类似物和酪氨酸激酶抑制剂)对 34 例脑膜瘤瘤周脑水肿患者的疗效,研究发现,贝伐单抗组瘤周脑水肿体积减少最为显着治疗组治疗期间平均减少20.007 cm3,其他治疗组瘤周脑水肿体积平均增加0.107 cm3。研究表明,贝伐单抗治疗瘤旁脑水肿有显着疗效,贝伐单抗对有症状的瘤旁脑水肿脑膜瘤患者具有显着的临床疗效,有助于改善患者的 生活质量和减少类固醇激素用量[13]。等 [14] 报道了一例用贝伐单抗治疗的患有难治性脑水肿的乳腺癌脑转移病例。患者出现神经功能衰退、严重失语、肢体运动障碍等临床症状。贝伐单抗使用了几天。贝伐单抗2个周期后,患者临床症状明显好转,患者再次能够独立行走。贝伐单抗治疗4个周期后,脑MRI图像显示脑转移灶和脑水肿明显减少。贝伐单抗使用了几天。贝伐单抗2个周期后,患者临床症状明显好转,患者再次能够独立行走。贝伐单抗治疗4个周期后,脑MRI图像显示脑转移灶和脑水肿明显减少。贝伐单抗使用了几天。贝伐单抗2个周期后,患者临床症状明显好转,患者再次能够独立行走。贝伐单抗治疗4个周期后,脑MRI图像显示脑转移灶和脑水肿明显减少。
日本一项临床研究通过分析局部脑血容量(rCBV)和瘤旁水肿表观扩散系数(ADC)的变化来评价贝伐单抗治疗复发性胶质母细胞瘤脑水肿的效果,贝伐单抗治疗2个月后,患者的 ADC 值和 rCBV 分别下降了 49% 和 32% [15]。该研究通过降低患者的ADC值和rCBV,证实了贝伐单抗的抗脑水肿作用。研究表明,ADC与恶性胶质瘤患者的预后相关[16]。较低的 ADC 预测接受过贝伐单抗治疗的患者的无进展生存期和总生存期更长 [17]。因此,贝伐单抗治疗复发性胶质母细胞瘤脑水肿的ADC值降低,
4 耐药性问题
贝伐单抗在恢复血脑屏障功能方面发挥着有益作用。在关注贝伐单抗疗效的同时,耐药性也成为了专家们关注的热点。瘤内缺氧被认为是血管生成抑制剂在实体瘤治疗中成功的表现,但由于增强的肿瘤增殖、肿瘤细胞侵袭和干细胞样肿瘤细胞的发育,最终限制了血管生成抑制剂的治疗潜力[18] . 研究表明,虽然贝伐单抗对恶性脑肿瘤和脑水肿有初步的治疗作用,但它可能很快导致受累血管过度修剪,导致血管供血不足,加重组织缺氧和坏死[19]。该研究还发现,尽管暂时减少了肿瘤体积和脑水肿,但贝伐单抗可以诱导更具侵袭性和耐药性的肿瘤间充质表型 [20]。等[7]报道17例放射性脑坏死合并脑水肿患者在伽玛刀放疗后接受贝伐单抗治疗。大部分脑水肿迅速缓解,7例患者在贝伐单抗停药数月后临床症状加重。,脑坏死周围的水肿再次出现并扩大。7例患者在贝伐单抗停药数月后临床症状加重。,脑坏死周围的水肿再次出现并扩大。7例患者在贝伐单抗停药数月后临床症状加重。,脑坏死周围的水肿再次出现并扩大。
贝伐单抗对 VEGF 的抑制可激活不同的促血管生成通路,促血管生成信号通路适应性上调,导致新的血管生成[21,22]。此外,贝伐单抗的应用导致血管过度修剪、组织缺氧,以及缺氧诱导的促进新生血管形成的血管生成因子的释放[23]。骨髓来源的促血管生成细胞也参与了对血管生成抑制剂的获得性耐药机制[24]。贝伐单抗抗血管生成治疗可诱导肿瘤组织缺氧,导致骨髓来源细胞在肿瘤部位聚集,刺激细胞生长因子表达,促进肿瘤生长。此外,前体骨髓细胞可以分化成新生血管结构所需的不同细胞,促进血管生成和新生血管[25,26]。研究还发现,间质细胞转化也是血管生成抑制剂耐药的关键[27]。等人 [19] 报道,贝伐单抗治疗可能导致胶质母细胞瘤的非增强 MRI 肿瘤进展,增加转化为胶质肉瘤的风险。
5 结论
尽管存在对贝伐单抗的耐药性,但其疗效仍存在争议。多数研究表明,贝伐单抗治疗恶性脑水肿具有良好的疗效和安全性,被认为是治疗恶性脑水肿的有效、安全的手段。贝伐单抗治疗恶性脑水肿的远期疗效、治疗时机和耐药性等方面仍需大样本临床试验进一步探索,以达到更好的治疗模式,改善患者预后。
参考文献(略)
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话