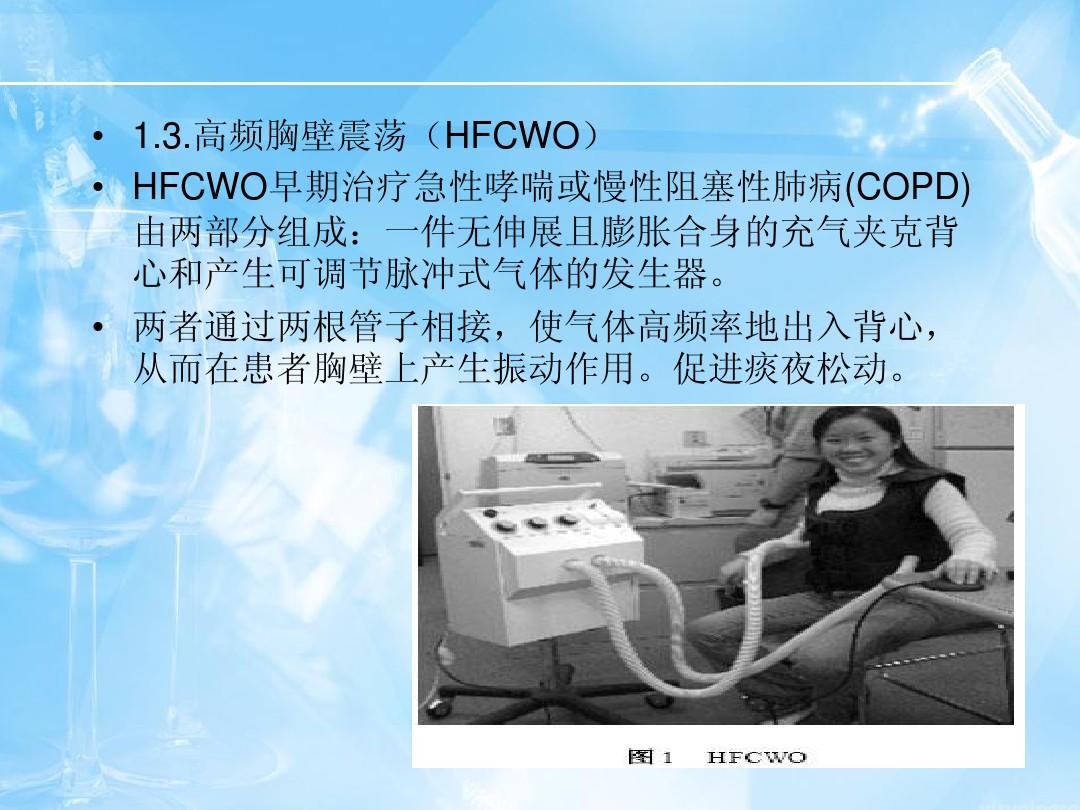
欢迎光临吉康旅!
2003年,美国FDA加速批准吉非替尼用于治疗铂+紫杉醇化疗后疾病进展的晚期非小细胞肺癌()患者。
2005年,国家食品药品监督管理总局(SFDA)批准其用于高级二线治疗;2010年获批用于表皮生长因子受体(EGFR)突变患者的一线治疗。
2015年7月,美国FDA批准吉非替尼一线治疗表皮生长因子受体(EGFR)外显子19缺失或外显子21()置换突变的转移性患者。
商品名称:(易瑞沙)
通用名称:(吉非替尼)
目标:EGFR
制造商:阿斯利康
美国批准:2003
在中国获批:2005
批准适应症:非小细胞肺癌
规格:*10
推荐剂量:每次,每天一次
价格:约2500元
2020年2月, of and (J Surg, )发表了复旦大学附属肿瘤医院陈海泉教授团队进行的一项II期、单臂、前瞻性临床研究的结果,旨在评估其疗效。吉非替尼作为 II-IIIA 期可切除非小细胞肺癌 () 患者新辅助治疗方案的疗效和安全性。
人群特征
所有患者的人口特征(n=35) 为:31% 男性和 68.6% 女性;中位年龄 57 岁;54.3% 的患者有 BMI(体重指数)≤24 kg/m2,45.7%的患者BMI>24 kg/m2;28.6%的患者有吸烟史;28.@ >6% 的患者有家族史;17.1% 的患者为 IIA 期,5.7% 的患者为 IIB 期,77.1% 的患者为 IIIA 期;6 8.6% 的患者有 EGFR 突变,31.4% 的患者有突变;93.9% 的患者进行了单叶切除术,6.1% 的患者进行了双叶切除术。
图例:接受吉非替尼新辅助治疗的患者人群特征
患者术前接受吉非替尼(250 mg,每天一次,共 42 天),然后进行手术切除。主要终点为客观缓解率(ORR),次要终点为主要病理缓解率(MPR,新辅助治疗后残留存活肿瘤≤10%)、无病生存期(DFS)、总生存期(OS)、不良反应( AE)。
临床数据
在入组的 35 名患者中,33 名患者(意向治疗人群、ITT 人群)接受了术前吉非替尼新辅助治疗,并接受了开胸和系统性淋巴结切除术。
在意向治疗人群中(n=33),客观缓解率(ORR)为 54.5%;没有患者达到放射学完全缓解(CR),12.@ >1% 达到病理 CR;54.5% 患者实现部分缓解 (PR);45.5% 患者实现疾病稳定 (SD);87% 患者实现完全切除。
图例:接受吉非替尼新辅助治疗的患者的 ORR 瀑布
意向治疗人群 (n=33) 的病理缓解率 (MPR) 为 24.2%;中位随访时间为 5 年;在初始图像和随后通过随访证实),因此未评估无病生存期(DFS)。
截至 2019 年 11 月,29 名患者中有 37.9% 无复发;中位 DFS 为 33.5 个月,实现 MPR 的患者数量为 33.5 个月,与未实现 MPR 的患者相比,患者的 DFS 更长。
在意向治疗人群中,66.7% 的患者存活;没有患者死于肺癌以外的其他原因;未达到中位 OS。
图例:新辅助吉非替尼治疗患者的 DFS 和 OS
所有患者均接受了辅助含铂双药化疗和/或放疗。辅助化疗方案为培美曲塞+顺铂,共4个疗程。辅助放疗方案为50~62Gy/25~28Fx。29 例患者中,62.@>1% 复发。此外,远处复发率为77.8%,其中脑转移6例。远处复发比局部复发更常见(22.@>2%)。
不良反应
常见的1/2级不良反应为:皮肤毒性(68.6%)、胃肠道症状(48.6%)、ALT升高(20.0%)、升高AST(8.6%)、痰多(8.6%)、肝病(5.7%)、咳嗽(5.7%)、胸闷(< @2.9%)、食欲不振(2.@>9%)、肌肉不适(2.@>9%)、甲沟炎(2.@>9%)、头晕(2.@> 9%)、贫血(2.@>9%)、血尿(2.@>9%)、尿胆原增加(2.@>9%)。

未发生 3/4 级不良反应。4例患者术后出现乳糜胸(12.@>1%)。
图注:吉非替尼新辅助治疗患者的不良反应
乳糜胸
由于各种原因,经胸导管回流的淋巴乳糜液漏出并积聚在胸膜腔内,称为乳糜胸。乳糜胸的发生与胸导管损伤或闭塞有关。
胸导管起源于第一或第二腰椎前的乳糜池,是将乳糜从腹腔输送到中央静脉系统的主要淋巴管。
胸导管从主动脉裂孔进入胸腔后,在食管后部的主动脉和奇静脉之间走行,在第4或第5胸椎水平处转向椎体左侧,然后汇入左颈内静脉或左锁骨下静脉。
这样的解剖结构可以解释为什么乳糜胸会发生在一个或两个胸腔中。
综上所述
吉非替尼的新辅助治疗在 II-IIIA 期患者中是安全的,并且可能是 EGFR 突变患者的可行治疗方法。提高 MPR 患者的生存率。
【重要提示】本公众号【全球良药资讯】所有文章信息仅供参考,具体治疗请遵医嘱!
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话