欢迎光临吉康旅!
2020年8月6日,基石药业(苏州)股份有限公司(以下简称“基石药业”,香港联交所代码:2616))宣布,其抗PD-L1单抗注射液在开发(以下简称“”)联合含铂化疗一线治疗IV期非小细胞肺癌()III期临床试验,经独立数据监测委员会(iDMC)评估达到了预先指定的主要研究终点,即联合安慰剂联合铂类化疗相比,铂类化疗显着延长了患者的无进展生存期(PFS),安全性良好,且未出现新的安全性信号成立。
-302 是一项多中心、随机、双盲 III 期临床试验,旨在评估联合铂类化疗与安慰剂加铂类化疗在一线初治 IV 期患者中的疗效和安全性。这也是国内首个涵盖鳞状和非鳞状病理亚型作为一线治疗的Ⅲ期临床试验。基石药业计划于近期向国家药品监督管理局(NMPA)提交新药申请(NDA)。
基石药业董事长兼首席执行官姜宁军博士表示:“目前国内尚无抗PD-L1单克隆抗体获批用于IV期,这是国内首个证明了联合化疗可显着提高中国患者PFS的单克隆抗体,有望成为全球首个获批用于联合化疗同时用于鳞状和非鳞状一线治疗的抗PD-L1单克隆抗体。令人振奋的发展将进一步推进研发,持续推动基石药业的商业化转型进程意义重大。”
抗PD-L1单克隆抗体联合含铂化疗的里程碑式进展
目前,肺癌已成为我国恶性肿瘤死亡的首要原因。根据国家癌症中心2019年新发布的全国癌症统计数据,肺癌占癌症总发病率的20.03%;肺癌导致的死亡占所有癌症死亡的 26.。99%。
从病理和治疗上看,原发性肺癌大致可分为小细胞肺癌和非小细胞肺癌两大类,其中非小细胞肺癌约占80%~85%。约80%的患者被发现时已处于中晚期,5年生存率很低,给治疗带来很大挑战。幸运的是,在抗击非小细胞肺癌的挑战中,创新分子靶向药物和抗PD-1单克隆抗体和抗PD-L1单克隆抗体免疫治疗的应用被视为里程碑式的进展。
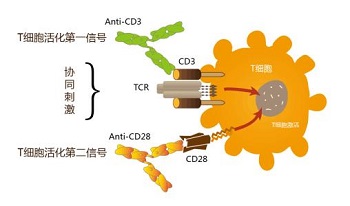
PD-1和PD-L1是抑制人体免疫反应的信号通路。PD-1负责关闭T淋巴细胞攻击正常细胞的功能;癌细胞表达PD-L1受体并与T淋巴细胞表面的PD-1结合,从而抑制T淋巴细胞对癌细胞的杀伤,导致免疫逃逸。抗PD-1单克隆抗体和抗PD-L1单克隆抗体可以解除免疫系统在肿瘤面前的“刹车”,重新启动自身免疫攻击肿瘤细胞的功能。T 淋巴细胞上的 PD-1 位点阻止两者结合。对于没有驱动基因的晚期非小细胞肺癌,从 PD-1/PD-L1 单一疗法到最新的抗 PD-L1 单克隆抗体联合 的含铂化疗的免疫疗法正在用于非小细胞肺癌患者。带来更多的光。
中国首个针对两种亚型的抗PD-L1联合疗法取得显着改善
基石药业的抗PD-L1单克隆抗体是最接近人体天然G型免疫球蛋白4(IgG4)单克隆抗体药物。与同类药物相比,抗PD-L1单克隆抗体在患者体内产生的免疫原更低性和相关毒性的风险在安全方面具有独特的优势。
-302研究首席研究员、上海肺科医院肿瘤科主任周才存教授表示:“我们很高兴看到-302研究在中期分析中达到了预先设定的主要终点。鳞状细胞癌患者的PFS安全性好,是全球首个抗PD-L1单克隆抗体联合化疗晚期随机双盲III期研究。
基石药业首席医学官杨建新博士表示:“与其他已发表结果的抗PD-1/PD-L1单克隆抗体联合化疗一线研究相比,-302研究采用了创新设计,是国内首创。国内首个同时涵盖鳞状和非鳞状亚型的一线III期临床试验,作为近500名患者的大型III期研究,尽管入组竞争激烈,受新冠肺炎的影响,从首例患者给药到发表主要研究结果仅用了20个月,我们将继续全面推进和更广泛地评估该产品在血液学、III期、晚期胃癌、肝癌和食管癌患者中的疗效和安全性。 ”
基石药业计划于近期向国家药品监督管理局提交新药申请(NDA),用于联合含铂化疗的一线治疗适应症。具体研究数据将在近期召开的学术会议上公布。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话