欢迎光临吉康旅!
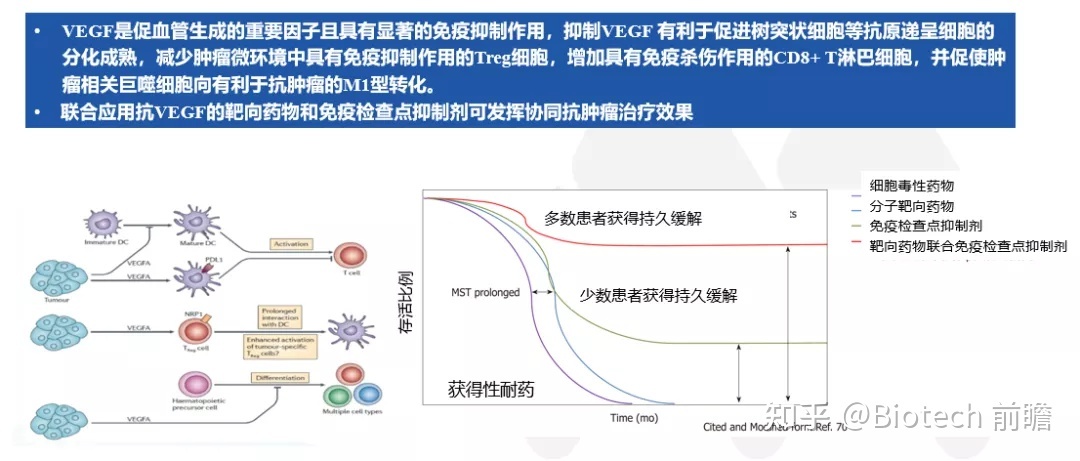
近年来,肝细胞癌(HCC)的全身治疗取得突破,特别是以免疫检查点抑制剂(ICI)为代表的免疫疗程,打破了分子靶向药物的单一治疗模式。抗血管生成靶向治疗策略显示出优势。
一线治疗
阿特珠单抗 + 贝伐单抗
该研究是一项国际多中心III期临床研究。共纳入 501 名不可切除的 HCC 患者,随机接受阿特珠单抗加贝伐单抗或索拉非尼单药治疗。最终结果显示,与索拉非尼相比,阿特珠单抗联合贝伐单抗显着提高了患者的中位总生存期(mOS):19.2 个月 vs 13.4 个月(HR=0. 66、P
辛迪利单抗+
-32研究是一项PD-1抑制剂联合方案在中国人群中一线治疗不可切除或转移性肝癌的随机、开放标签、对照II/III期研究,其中新治疗571例患者被纳入 III 期部分。患有不可切除或转移性 HCC 的患者被随机分配接受 PD-1 抑制剂 联合治疗(贝伐单抗生物类似药)或索拉非尼单药治疗。结果显示,与索拉非尼相比,信迪利单抗联合用药显着改善了患者的mOS(尚未达到vs 10.4个月,HR=0.57,P
卡瑞利珠单抗联合阿帕替尼
这是一项在中国 25 个中心进行的非随机、开放标签、多中心、II 期临床研究。该研究招募了未经治疗或一线靶向治疗难治的HCC患者,旨在评估联合apa替尼治疗晚期HCC的疗效和进展。结果:独立审查委员会 (IRC) 评估的卡瑞利珠单抗联合阿帕替尼在一线和二线治疗队列中的 ORR 分别为 46% 和 25%。一线mOS为20.1个月,二线mOS为21.8个月。该研究为肝癌一线治疗带来了突破性的疗效数据。
派姆单抗联合乐伐替尼
-524 是一项 1b 期、开放标签、单臂、多中心研究,旨在评估 + 联合治疗不可切除 HCC 的耐受性和安全性。结果显示,派姆单抗联合乐伐替尼一线治疗(n=100例)的ORR为36%(v1.1),mPFS为8.6个月,mOS达到22.0个月,该联合方案的成功进一步推动了免疫联合TKI在HCC中的探索。
纳武利尤单抗
459 是一项开放标签、全球 III 期临床研究,在晚期 HCC 患者的一线治疗中,纳武单抗头对头与索拉非尼相比。结果显示,与索拉非尼相比,纳武利尤单抗在主要终点OS(16.4 vs 14.7个月,HR=0.85,P=< @0.075),但OS有改善趋势,ORR为15%,具有一定的临床意义和良好的安全性,G3/4级TRAE为22%,索拉非尼组为49% . 研究虽然是负面的,但也对晚期HCC的治疗起到了积极的推动作用。
二线治疗
纳武利尤单抗
-040研究在肝癌领域免疫疗法的发展中发挥着至关重要的作用。对于既往接受过索拉非尼治疗的患者,纳武利尤单抗的 mOS 为 15.6 个月,ORR 为 14%,中位缓解持续时间 (mDOR) 为 17 个月。正是基于-040研究的结果,纳武单抗被FDA批准用于肝癌的二线治疗。这是 FDA 批准的首个用于该适应症的免疫肿瘤药物,为接受索拉非尼治疗的 HCC 患者提供了新的治疗选择。
派姆单抗
He-224研究确立了免疫疗法在肝癌二线治疗中的地位。- 224 1 结果显示,派姆单抗在 HCC 二线治疗中的 ORR 为 17%,mPFS 为 4.9 个月,mOS 为 12.9 个月。基于该研究结果,FDA于2018年11月批准派姆单抗用于晚期HCC的二线治疗。
卡瑞利珠单抗
国内一项 治疗既往接受过索拉非尼和/或含奥沙利铂全身化疗的晚期 HCC 的 II 期临床研究纳入 217 例患者,分别接受 3 mg/kg 静脉输注,2 次/周或 3 次/周治疗,总体ORR为14.7%,DCR为44.2%,mOS为13.8个月,2周疗效和安全性无显着差异给药和 3 周给药方案。最常见的 TRAE 为反应性皮肤毛细血管增生( ),发生率为 66.8%(均为 G1/2),与 ORR 呈正相关,G3/4 TRAE 的发生率为66.8%)。22%。基于这项研究,
替雷利珠单抗
208 研究是一项全球性、多中心、II 期研究,旨在评估替雷利珠单抗在不可切除 HCC 患者二线及以上治疗中的疗效和安全性。该研究包括接受过一线治疗和二线或以上治疗的 HCC 患者,这些患者接受了 IV Q3W。替雷利珠单抗的 ORR 为 13.3%,疾病控制率 (DCR) 为 53%,mPFS 为 2.7 个月,mOS 为 13.2 个月,12 个月DOR率为79.2%。根据这项研究的结果,NMPA 于 2021 年 6 月批准了替雷利珠单抗用于治疗至少接受过一种全身治疗的 HCC。
卡瑞利珠单抗联合阿帕替尼
II期研究显示,卡瑞利珠单抗联合阿帕替尼二线治疗(n=120例)的ORR为23%(.1),mPFS为5.5个月,mOS可达2 1.8 个月。
纳武单抗+易普利姆玛
040 研究的队列 4 调查了纳武利尤单抗联合易普利姆玛治疗索拉非尼不耐受或进行性晚期 HCC 的疗效和安全性。148 例接受三种不同联合剂量方案治疗的患者的总体 ORR 达到 31%(.1)。其中,A 组(纳武利尤单抗 1 mg/kg 联合易普利姆玛 3 mg/kg,3 次/周,4连续周期的纳武利尤单抗,序贯纳武利尤单抗(240 mg,2次/周)mOS最长,达到22.8个月,ORR为32%,TRAE发生率最高(G3/4:53 %),安全性尚可。基于上述研究结果,FDA于2020年3月批准纳武单抗联合易普利姆玛(A组剂量)用于晚期HCC的二线治疗。
特殊人群的免疫治疗
特殊 HCC 人群的治疗仍然很困难,大多数临床研究并未解决这些医疗需求。根据《肝细胞癌免疫治疗中国专家共识(2021年版)》,特殊HCC人群应用免疫治疗应注意以下问题:
特殊人群
建议
器官移植
鉴于移植排斥和致死性的高风险,不推荐对肝移植后肿瘤复发的患者常规使用 ICI 治疗(III,D)。如果没有其他治疗选择,是否开始 ICI 治疗应与患者和移植外科医生充分沟通。
-Pugh B 级和 C 级
对于 -Pugh B 级肝功能相对较好(IIb,B)的 HCC 患者,可谨慎考虑 ICI 治疗,建议对 -Pugh C 级患者进行最佳支持治疗。
纤维板层 HCC 和混合肝细胞-胆管癌
纤维板层 HCC 和混合 HCC 的全身治疗缺乏循证医学,包括免疫治疗 (III, I)。未来,篮子试验或伞式试验可用于探索这些罕见病理类型 HCC 的靶向和免疫治疗选择。
自身免疫性疾病 (AD)
ICI 治疗对于轻度活跃或未接受 AD 治疗的患者不是绝对禁忌症,但应谨慎使用(III,C)。自身免疫性神经系统疾病或危及生命的 AD 患者,尤其是免疫抑制药物无法控制或需要大剂量控制病情的患者,不适合 ICI 治疗。
慢性肾病
由于缺乏大规模的研究数据和足够的临床应用经验,严重肾功能不全患者应慎用免疫治疗(Ⅲ,C)。
与 HIV 合并感染
在抗逆转录病毒治疗下,HIV感染的肿瘤患者接受ICI治疗可能具有潜在可行性,但HCC患者的报道很少,但需要积累更多的临床数据和经验,临床使用应慎重。 Ⅱb,C)。
联合门静脉癌栓(PVTT)
对于 PVTT 患者,免疫治疗联合抗血管生成靶向治疗是首选的全身治疗。由于PVTT受累程度、肝内肿瘤负荷、肝外转移和肝功能状态存在差异,PVTT患者异质性较大,建议多学科参与讨论(Ib,A)。
参考:
1.肝细胞癌免疫治疗中国专家共识(2021年版)。中华医学杂志, 2021, 101(48) :3921-3931.
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话