欢迎光临吉康旅!
摘要: 背景:肺癌(lung )是最常见的恶性肿瘤之一,严重威胁人类健康。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)是EGFR突变非小细胞肺癌(Non-cell lung)患者的首选治疗方案,但几乎所有患者都无法逃脱耐药性。以往对 TKI 继发性耐药的研究主要集中在肿瘤本身。随着免疫治疗的快速发展,人们逐渐意识到肿瘤免疫微环境与肿瘤细胞的相互作用也会影响治疗过程。因此,研究肿瘤免疫微环境在肿瘤TKIs耐药中的作用机制势在必行。研究方法:基于基因(GEO)数据库,使用R语言分析奥希替尼耐药前后EGFR/突变细胞系的RNA测序数据。(.0)分析信号通路、细胞因子和免疫细胞之间的相关性,并用-分析信号通路、细胞因子和免疫细胞与肺癌预后的关系。
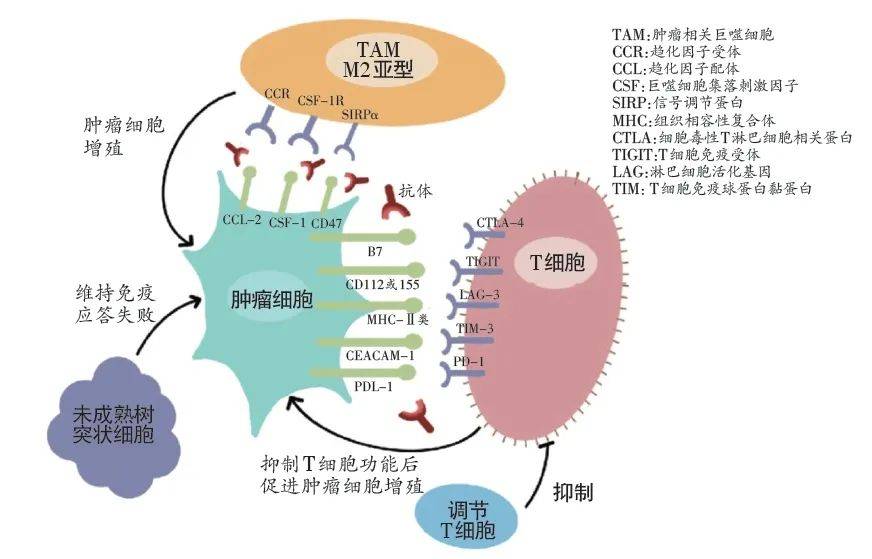
构建稳定转染的携带人/突变的小鼠非小细胞肺癌细胞系,并利用该细胞系构建小鼠皮下异种移植模型,用于奥希替尼耐药性研究。根据奥希替尼治疗期间小鼠皮下肿瘤体积和大小的变化,在奥希替尼给药前测定药物敏感性和耐药性三个时间点。采用流式细胞仪(Flow)和免疫组化(,IHC)研究上述三个时间点肿瘤免疫细胞浸润率的变化,采用酶联免疫吸附试验(,,)研究肿瘤和免疫细胞的变化。分泌细胞因子,利用 (,WB)研究肿瘤细胞信号通路的变化。肿瘤对奥希替尼耐药后,MAPK与NF-κB信号通路抑制剂联合治疗,观察肿瘤体积变化及耐药性是否逆转。然后,本次采用流式细胞仪、IHC、WB等方法进行研究。肿瘤免疫微环境。结果:对GEO数据库中奥希替尼耐药前后细胞系RNA测序数据分析显示,肿瘤细胞MAPK、NF-κB、TGF-β、VEGF信号通路在奥希替尼耐药后被激活。进一步分析发现,上述4条信号通路与CD8+ T细胞和CD4+ T细胞数量呈正相关,并与M2型肿瘤相关巨噬细胞(M2型,M2),骨髓源性免疫抑制因子)相关。细胞数 (- , ) 与调节性 T 细胞数 ( T , ) 呈负相关。
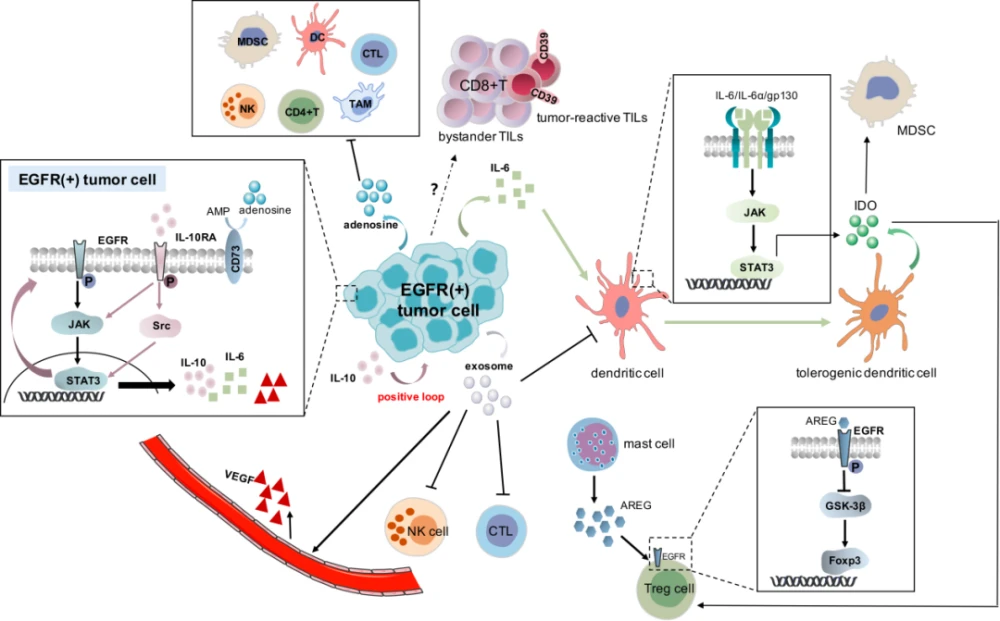
而TGF-β和VEGF信号通路无明显变化。细胞因子方面,arg1、IL4、IL10、IL34的表达和分泌增加,干扰素-γ(-γ,IFN-γ)的表达和分泌减少。同时,抑制 MAPK 和 NF-kB 信号通路可以减少奥希替尼耐药小鼠皮下肿瘤的体积。上述信号通路对肿瘤抑制作用不明显。此外,我们发现在同时抑制 MAPK 和 NF-κB 信号通路后,M2、、、、argl、IL-4、IL-10、IL34 的表达和分泌减少,CD4+ T 细胞减少. , CD8+T 细胞, M1 的比例和 IFN-γ 的表达和分泌增加,
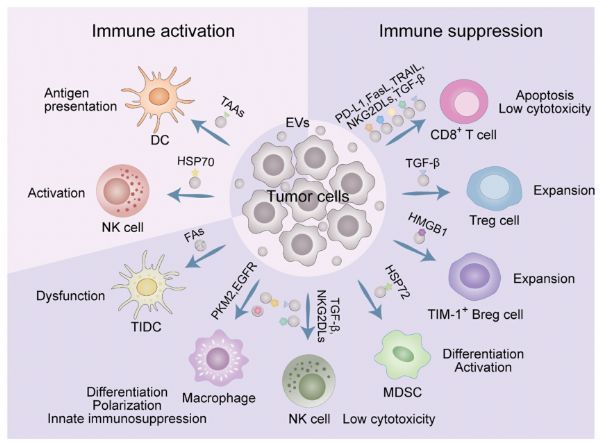
结论:EGFR/突变肿瘤免疫微环境在奥希替尼敏感期被激活,奥希替尼耐药期处于抑制状态。奥希替尼耐药后,肿瘤NF-κB和MAPK信号通路被激活,通过分泌IL-4、IL34等免疫抑制细胞因子,募集M2、、、、等免疫抑制细胞,降低CD4+ T细胞等杀伤细胞的免疫激活. ,CD8+ T 细胞的比例,M1。免疫抑制细胞分泌arg1,IL10抑制CD8+T细胞功能,降低IFN-γ的表达和分泌,塑造免疫抑制肿瘤微环境,导致奥希替尼耐药。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话