欢迎光临吉康旅!
《和》2020年10月[31(4):603-611.]发表美国H, Dave, H的综述《脑转移的化疗》(doi: 1 0.1016/j.nec.2020.06.009.)。
化疗在实体癌脑转移的辅助治疗中起次要作用。脑转移瘤的血脑屏障和自我保护机制已成为化疗给药和疗效的重要障碍。然而,随着技术的发展和靶向分子治疗的发展,出现了许多旨在克服这些挑战的方法。聚焦超声和分子特洛伊木马是增加血脑屏障对效应剂的渗透性的两种新方法。已发表的关于这些靶向疗法疗效的数据在很大程度上仍仅限于回顾性研究和 II 期前瞻性临床试验。
重点
化疗历来在脑转移瘤 (CM) 的辅助治疗中发挥次要作用,这在很大程度上是因为其穿透血脑屏障的能力较差。
对于化疗药物的输送,聚焦超声和“分子特洛伊木马”是提高血脑屏障穿透性的两种新方法。
有充分的证据表明,贝伐单抗 ( ) 作为一种有效的辅助药物可抑制脑转移瘤 (CM) 中的血管生成。
有一些高水平的数据支持酪氨酸激酶抑制剂的信号转导抑制作用,主要是在乳腺癌脑转移瘤(CM)中。
到目前为止,检查点抑制剂在黑色素瘤和非小细胞肺癌脑转移瘤(CM)中的疗效尚不明确,但一些临床试验正在进行中。
介绍
现代神经肿瘤学多学科治疗方法可将预后良好的脑转移 (CM) 患者诊断后 1 年的生存率提高 19%。然而,在所有原发性癌症中诊断出脑转移 (CM) 后的存活率仍然很低,尤其是在具有不利特征的患者中。由于缺乏高水平的数据,目前尚不清楚化疗对脑转移瘤的确切效果大小,但一些研究表明,化疗具有一定的原发性,如果纳入多模式治疗策略,可以延长生存期。本文综述了新剂型的研究进展。
脑转移化疗史
了解过去的治疗失败可以帮助我们了解当前的治疗策略。血脑屏障(BBB)是众所周知的脑转移瘤(CM)化疗的屏障。血脑屏障选择性中的内皮紧密连接和特异性转运蛋白允许具有特定电荷、亲脂性、大小和结合亲和力的分子进入大脑。此外,在所谓的“血肿瘤屏障 (BTB)”中的外排泵(药物浓度。即使是容易穿过血脑屏障、常用于治疗脑转移瘤(CM)的药物,如烷化药物(如替莫唑胺),
总之,脑转移瘤 (CM) 的病理环境提醒研究人员他们在治疗这种特殊形式的癌症时面临的特殊障碍。这强调了需要开发新的和深奥的方法来提高全身化疗的有效性,从而改善患者的生活质量。
新的输送系统
生化破坏
自 1970 年代初以来,研究人员就已经知道,甘露醇会导致脑细胞收缩,同时“松动”(“of”)紧密连接会增加中枢神经系统 (CNS) 的通透性。然而,这种方法的主要缺点是方法是它的非特异性和作用持续时间,这可能导致高度疾病诱导的临床后果,例如继发于脑水肿和生理改变的癫痫发作。在 1980 年代,他的同事使用血管活性化合物(如缓激肽)来增强大分子在整个血管中的运动血肿瘤屏障 (BTB)。这种方法也有同样的缺点。而各种其他血管活性药物(例如,白细胞介素2、坏死因子 α,烷基甘油)已被探索,因为它们具有增强 BBB 通过血脑屏障进行化疗的潜力,但由于疗效有限、副作用显着,并且与原发性中枢神经系统肿瘤不同,尚无药物被证明具有持久的成功。对脑转移的了解仍然不完整(CM 对 CNS 的作用)。
聚焦超声
血脑屏障(BBB)的物理破坏最近已成为解决这些问题的有希望的解决方案。作为热疗的一种形式,聚焦超声期间发出的声波可以通过多种机制瞬时增加血脑屏障的通透性,可通过同步 MRI 检测到。多项研究和至少一项临床试验已经得出结论( )这一发现。该技术因其实用性、普遍性、廉价性和非侵入性而受到重视。它允许高达 2000 kDa(千道尔顿)的分子通过,并且在动物研究中没有报告任何已知的有害影响。它作为其他化疗方案的辅助使用进一步强调了它在神经外科肿瘤医疗设备中的重要性。
特洛伊木马策略
内吞作用 ( ) 利用 ( ) 具有特定配体的天然分子与血脑屏障内皮细胞上的受体结合,从而将治疗药物输送到中枢神经系统的内源性机制。通常称为(至)“分子特洛伊木马()”,这些方法包括但不限于:标记结合的胰岛素和激素信号(-),使用工程重组融合蛋白结合效应部分(使用t to ) 和化学治疗性脂质 质体区室化结合肿瘤血脑屏障特异性受体(结合 - 的 to )。几个研究小组主要使用纳米颗粒和微粒(和)在小鼠模型中提供联合化疗。最近的动物数据表明,当这些新型纳米载体与上述聚焦超声技术结合使用时,通过血脑屏障的转运会进一步增强。然而,根据一些作者的说法,基于纳米粒子的载体系统的有效性仍有待实现。
新药
较新的药物,如酪氨酸激酶抑制剂 (TKI)、非 TKI 和检查点抑制剂,根据其分子方向被描述为靶向治疗(表 1)。受数据刺激和有希望的几个低水平从随机临床试验的早期结果来看,近年来对这类药物的研究急剧加速。
血管生成抑制

研究表明,由于新的肿瘤相关血管缺乏正常的血脑屏障特性,一旦脑转移瘤超过 1 至 2 毫米,血脑屏障就会受到损害。贝伐单抗是一种针对血管内皮生长因子 (VEGF) 的重组单克隆抗体 (MAb),已被证明是一种化学增敏剂,可通过减少肿瘤血管生成和改善药物渗透来改善肿瘤反应。对化疗的反应率。因此,它被纳入美国食品药品监督管理局(FDA)批准的联合铂类化疗的非小细胞肺癌(non-cell lung)一线全身治疗方案。
几项随机研究,包括与他的同事在 2000 年代初发表的研究,以及 Tang 及其同事最近的一项回顾性分析,表明与单独的化疗相比,贝伐单抗联合治疗的总生存率(OS)显着增加靶向治疗。II 期数据还显示了贝伐单抗联合 的增强作用, 是一种抗程序性细胞死亡蛋白-1 [PD-1] mAb,可能继发于增强细胞死亡蛋白-1 (PD-1)@ >)。根据 Shah 及其同事的综合评价,两种 VEGF 受体 2 (-2) 抑制剂,(Kabo () 和 ()) 也已被研究用于治疗乳腺癌脑转移瘤 (BCCM) 的潜力). (卡博替尼), a -2 和辐射抗性诱导的 c-MET 酪氨酸激酶抑制剂已在多个 II 期试验中进行了研究,研究了与常规药物一起使用时对脑转移瘤 (CM) 的影响。(乐伐替尼)也在激素阳性乳腺癌脑转移中进行了研究(在 BCCM 进行了类似的研究),但结果尚未公布。
全身给药的索拉非尼 ( )、舒尼替尼 ( )、帕唑帕尼 ( ) 和凡德他尼 ( ) 还通过抑制多种机制来抑制肿瘤血管生成(见表 1) @>。这些被恰当地称为多激酶()抑制剂,不幸的是已显示在至少两项不同的动物研究中 CNS 浓度较差,可能是通过类似于通过 P-GP(P-糖蛋白)和 BCRP(乳腺癌抗性蛋白)激活肿瘤细胞的 TKI 流出(TKI from)的机制。同事注意到,有几项 II 期试验旨在确定这些药物在非小细胞肺癌和肾细胞癌患者中的疗效安全性和有效性,关于其疗效的数据大多限于病例报告和研究系列。
信号转导抑制
大量信号转导抑制剂对脑转移(CM)患者总生存期(OS)的影响已有报道和研究(见表1)。靶向表皮生长因子受体(EGFR)和人表皮生长靶向因子受体2(HER-2))的药物的开发可能预示着这些靶向治疗的到来。大量研究表明靶向EGFR突变的TKI具有反应性,例如第一代药物厄洛替尼。在他们的 II 期研究中,Wu 及其同事报告说,在 EGFR 突变组和 EGFR 野生型组中,厄洛替尼治疗组的无进展生存期 (PFS) 增加了近 11 个月。
同样,Heon 及其同事报告的回顾性数据显示,当使用这些药物代替常规化疗时,CNS 进展减少了 15%。然而,对 EGFR 靶向治疗的耐药率估计为 30%,仅导致短暂的反应。针对 EGFR、HER-2 和其他信号介质的第二代 TKI,如阿法替尼 ( ) 和来那替尼 ( ),旨在纠正这些缺陷,但很少有临床成功发表。
拉帕替尼 ( ) 是一种 EGFR 和 HER-2 抑制剂,通常与曲妥珠单抗 ( ) 一起使用,曲妥珠单抗是一种靶向 HER-2 的单克隆抗体,用于治疗转移性乳腺癌。来自几项 II 期临床试验的数据表明,拉帕替尼在减少 CNS 肿瘤体积方面具有适度但可察觉的效果(但)。此外,在一项针对 399 名女性的研究中,与传统化疗相比,拉帕替尼联合卡培他滨可使 CM 进展率降低 4%。及其同事进一步报道了 65% 未经治疗的乳腺癌脑转移 (BCCM) 患者的客观中枢神经系统反应。最近对有关该主题的主要 III 期试验的评论( 、 和 )与现代化疗方案的结果一致( ),即拉帕替尼在管理一部分脑转移瘤中具有特定作用。
和 是 1 型 BRAF 激酶抑制剂的例子(见表 1)。已经在未经治疗的无症状病变的小群患者中看到了这些药物) 减少了脑转移瘤中的肿瘤体积。然而,尽管在后续 II 期试验和初步研究中证明了活性,但样本量小和对无进展生存期 (PFS) 的影响不显着似乎阻碍了正在进行的研究 (有)。然而,一些作者提出,在患有脑转移瘤 (MMCM) 的 BRAF 阳性转移性黑色素瘤患者亚群中,这些药物在与其他治疗联合使用时可能仍然存在,有助于诱导脑转移瘤 (CM) 的消退。
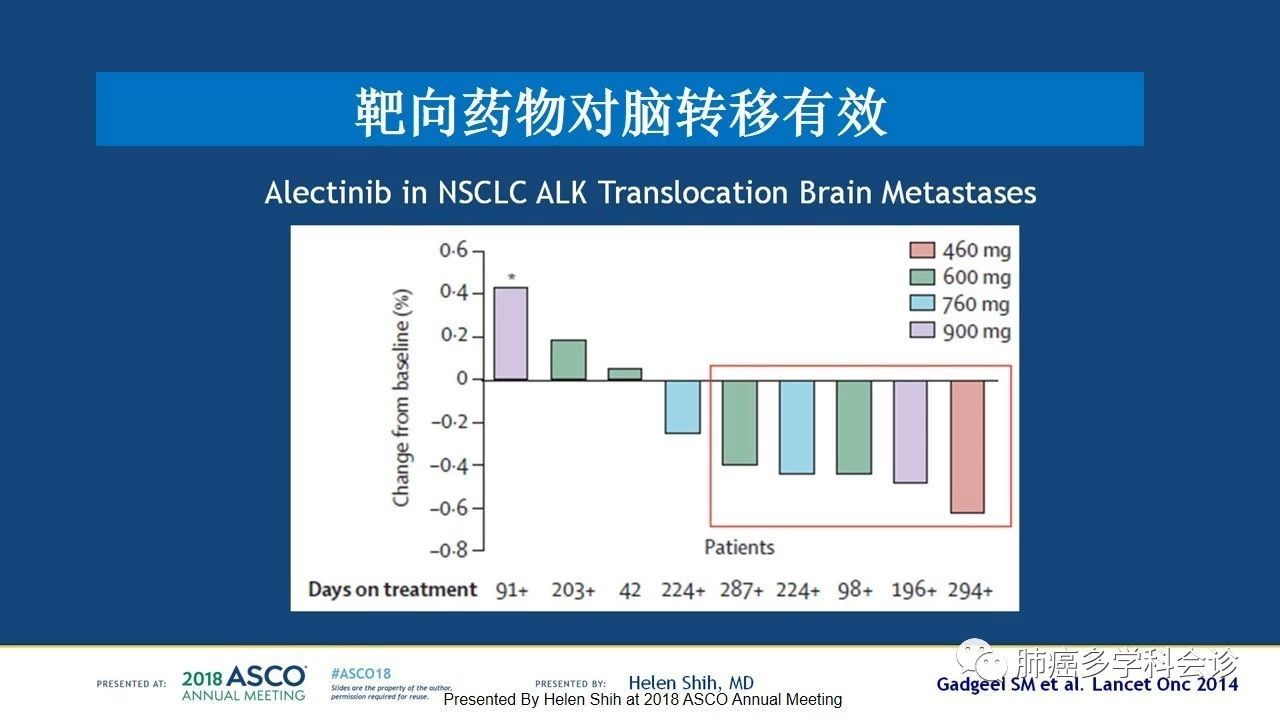
克唑替尼 ( ) 是间变性淋巴瘤激酶 (ALK) 的抑制剂,ALK 是侵袭性 ( ) 亚型中的一种罕见突变。尽管 CSF 浓度较低,但克唑替尼在早期 II 期研究中显示出一些效果。然而,下一代药物色瑞替尼( )和艾乐替尼( )在这方面有所改善,被认为代表了治疗 ALK 阳性脑转移瘤的未来,特别是对一线克唑替尼耐药或难治性患者的治疗。这些早期数据促使 ALEX() 的 3 期临床试验对这些药物治疗非小细胞肺癌脑转移的疗效进行了头对头的比较。结果于 2017 年发表,称赞艾乐替尼与克唑替尼相比具有卓越的疗效和更低的毒性,
针对细胞周期蛋白依赖性激酶 4 和 6(CDK4/6) 和磷酸肌醇 3 激酶 (PI3K) 的治疗目前仅限于转移性乳腺癌。一些 II 期甚至一些 III 期临床试验研究了 CDK4/6 的安全性和有效性抑制剂作为一线治疗并与抗激素全身化疗联合使用,包括和 () 系列试验 ();() 和 () 试验 ();-3、TEEL 和 -2() 和 -3() 试验()。虽然结果数据的荟萃分析证实使用这些药物可以改善无进展生存期,但乳腺癌脑转移在许多研究标准中被排除在外,在其他研究中仅在严格条件下被纳入。其他人尚未发表他们的结果,但扩大这些试验的使用可能会纠正这个问题。
PI3K抑制剂(),有着同样的前景,但也面临同样的挑战。在 CNS 定植期间,PI3K 及其促进脑转移 (CM) 的能力已通过实验室研究得到证实。III-1 期试验()、III-2 期()和-3 期试验()和 II 期和 III-4 系列试验()、Ib 期 B-YOND 试验()和 II 期 STAR Cape 试验(全部)以及至少一项 I 期试验,调查一些 BCCM 患者随机接受 PI3K 抑制剂、曲妥珠单抗、卡培他滨或其他激素治疗的组合。虽然这些研究的一些结果尚未确定,但其他研究发现无进展生存(PFS)率没有统计学上显着的实际变化,这表明需要对这些靶向治疗和 BCCM 患者进行进一步研究,
BCCM 和雷帕霉素 (mTOR) 抑制剂的哺乳动物靶向对照临床试验数据较少(见表 1)。早期数据表明,将其纳入多药化疗方案可能是合理的(特别是)。有趣的是, -3 试验以 mTOR 治疗失败或进展的患者为前提),但包括脑转移(CM)在内的研究仍需要验证。至少一项最近发表的 1 期临床试验调查了贝伐单抗 一个由 5 名复发性脑肿瘤患者组成的小儿科队列,与依维莫司联合治疗。另一项试验研究了与芳香酶抑制剂、上述 或 PI3K 抑制剂联合使用时和 BCCM 的作用。
检查点抑制
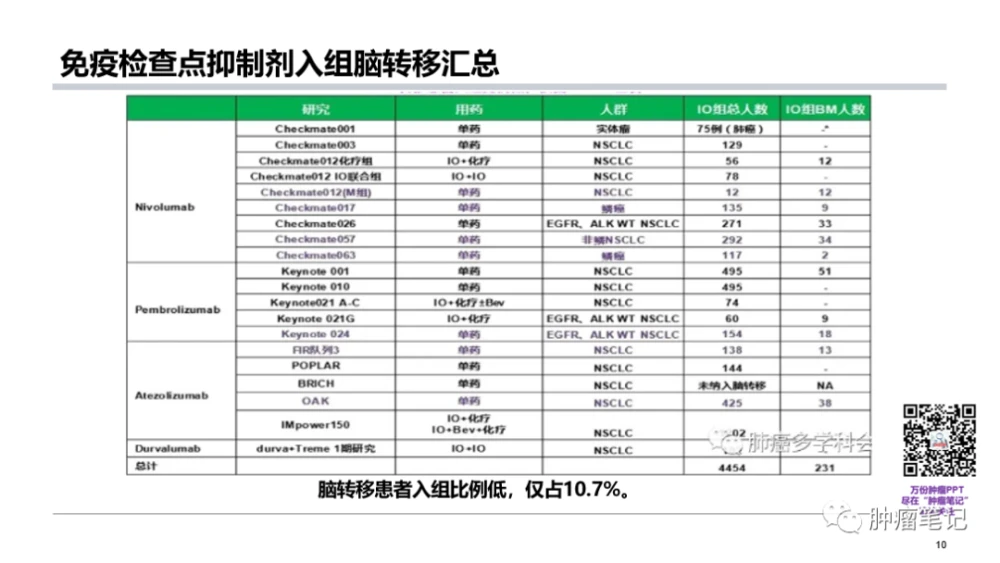
免疫疗法或所谓的“检查点抑制”作用背后的前提是,幼稚免疫细胞可以通过激活或抑制免疫受体分子进行编程来防御 CM,从而阻止对癌症肿瘤标志物的免疫耐受,并允许细胞毒性免疫细胞预防肿瘤静止期( )(此类常见药物见表1)。迄今为止,对这些检查点抑制剂的研究大多局限于对黑色素瘤(MM)和非小细胞肺癌()的回顾性研究。研究。
Hodi 及其同事在 2010 年的一项 III 期临床试验中证明,当给予先前治疗的 MM 患者(易普利姆玛)时,总生存期(OS)适度增加了 4 个月。然而,黑色素瘤脑转移(MMCM)患者被排除在外。两年后,一项针对 72 名黑色素瘤和脑转移瘤 (CM) 患者的前瞻性 II 期试验发现,单药治疗在其队列中的一个无症状 CM 亚组中有效。其他研究调查了易普利姆玛、派姆单抗和纳武单抗(、、和)与其他辅助治疗选择(包括放射治疗)的各种组合。
一项 II 期临床试验 204 表明,每 3 周服用四剂 和 可使 MMCM 患者的颅内临床获益达 57%。相同设计的 ABC 试验报告,在最大限度地接受这种联合治疗的患者中,6 个月的颅内 PFS(无进展生存期)率为 53%,OS(总生存期)率为 78%。在这两项研究中,这种联合治疗与显着的不良事件发生率相关:总体为 55%,联合治疗组为 97%。最常见的 3 级或 4 级不良事件是皮疹、腹泻、转氨酶升高、肝炎和脂肪酶升高。
PD-1 靶向组合()单独的化疗策略已应用于黑色素瘤和 . 一项 II 期试验报告, 治疗和 MMCM 患者的颅内反应率分别为 33% 和 22%。缺乏前瞻性和随机临床数据。然而,回顾性研究已经产生了谨慎和有希望的结果。
目前仍在进行临床试验,但只有零星的病例报告显示 CM 患者的 PFS 或 OS 有临床显着改善。2016 年对现有 MMCM 研究的系统评价发现,尽管在这种癌症类型中对检查点抑制剂至少有可测量的反应,但回顾性研究和临床试验中的中位总生存期 (OS) 分别仅为 4.3 个月和 7 个月。
总结
传统上,脑转移瘤(CM)的化疗一直受到血脑屏障(BBB)和血肿瘤屏障(BTB)等屏障的限制。最近的回顾性和前瞻性研究以及少数 III 期临床试验表明,新方法意味着输注下一代化疗药物可以为 CM 患者带来适度的生存益处。然而,这些结果被谨慎地报告,因为统计学意义尚未转化为对不同肿瘤亚型患者有意义的益处。未来的研究希望通过绕过这些障碍的技术最大限度地提高这些化疗药物的疗效,同时最大限度地减少这些药物的副作用。
结尾
免责声明:脑医资讯、神杰资讯、脑医咨询所发布内容的知识产权归脑医汇、主办方、原作者及其他相关权利人所有。未经许可,禁止转载、摘编、复制、剪切、录音等。经许可使用,还必须注明来源。欢迎转发和分享。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话