欢迎光临吉康旅!
近日,JTO发布了一个新病例,患者在靶向治疗失败后巧妙地使用了联合方案,为大家带来了有效的治疗思路。让我和你分享这个案例。
ALK靶向治疗无效,先用贝伐克+化疗“过渡”,再挑战TKI成功缩小肿瘤
案例展示
一名 36 岁晚期非小细胞肺癌女性患者,ALK 重排阳性,无吸烟史,确诊后接受二代靶向药物(TKI)艾乐替尼一线治疗。但肿瘤并未成功控制,肺部病灶继续增大,胸腔积液增多,患者无不良反应。随后,患者接受了贝伐单抗(一种抗血管生成药物)联合化疗(培美曲塞+铂)的治疗,尽管肿瘤缩小了,但患者在化疗期间仍会出现恶心。当肿瘤再次进展时,患者因害怕严重恶心而拒绝其他化疗方案。最后决定再次使用艾乐替尼。2个月后,患者原发灶明显缩小,
图A为艾乐替尼初治前CT肺肿瘤(轻度气胸为医源性胸腔引流所致),图B为艾乐替尼初治后,图C为艾乐替尼再次给药前(即贝伐单抗+化疗),图 D 显示重新给药艾乐替尼后肿瘤显着缩小。
研究人员从患者初次使用艾乐替尼前后的胸腔积液样本中建立了两种细胞系(称为ABC-19和ABC-23),并在体外使用艾乐替尼,测试了这两种细胞系的杀伤能力。发现两种细胞系的IC50分别为0.06和0.07 μM,均对艾乐替尼治疗敏感,基因检测也未发现继发耐药突变。因此,研究人员认为,患者对艾乐替尼产生原发性耐药的原因与继发性突变无关。
研究人员认为,贝伐单抗的使用成功地让患者“重新挑战”了 TKI,并提高了艾乐替尼对肿瘤的杀伤作用,原因有以下三个:
①当一线使用艾乐替尼无效时,经贝伐单抗+化疗治疗后,可再次使用艾乐替尼。
②分子检测未发现耐药突变,故无法从基因层面解释原发耐药的原因。
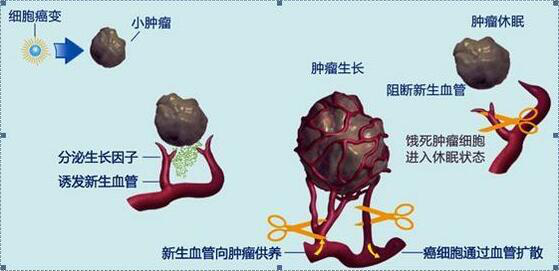
③患者胸腔积液癌细胞的体外研究表明,无论在哪个时间点(首次使用艾乐替尼之前或之后),艾乐替尼均具有良好的杀伤肿瘤细胞能力,且药物在体内给药。无效的原因可能是由于空间阻塞,药物不能有效地分布到肿瘤组织中。后来,当使用抗血管生成药物贝伐单抗时,对肿瘤的杂乱无章的血管系统进行了重新调整和修剪,让亚历克替代了肿瘤。Ni可以畅通无阻地发挥作用。
抗血管药一石二鸟!? 不仅能“饿死”癌细胞,还能帮助TKI驯服这个坏小子
特别有趣的是,抗血管生成药物不仅自身具有抗肿瘤作用,还可以增强其他药物的疗效。我们知道,在正常组织中,血管系统有规律地由成熟的血管组成,它们是由促血管生成分子和抗血管生成分子的平衡和协调形成的(下图a)。这种情况下不能使用抗血管药物。会改变。
肿瘤组织血管分布异常紊乱,主要由未成熟血管组成。通透性、血管直径、血管长度、血管密度、曲折程度、组织液压力均高于正常水平,影响治疗药物和营养。交货(下图 b)。如上所述,巧妙地使用抗血管生成药物可能会“精简”未成熟的血管,使肿瘤血管正常化,并创建一个有利于药物分布的“规范”网络,这是协同作用的(下)。图 c)。但是,抗血管药物也可以通过修剪/凝固肿瘤新血管,减少肿瘤血供(下图d)来“饿死”肿瘤,这也是该药研发的主要目的。
毫无疑问,贝伐单抗增强型 TKI 的病例也可见于其他突变类型的患者,例如 EGFR。尤其是在第三代EGFR-TKI奥希替尼耐药后没有可用药物的情况下,更需要这种“机会主义”的方案进行抢救,如下图。
奥希替尼耐药后,加用贝伐单抗可缩小肿瘤,延缓进展
1.奥希替尼耐药后加用贝伐单抗,症状缓解,肿瘤也缩小了
患者女,66岁,无吸烟史,2011年2月确诊为右肺腺癌(IV期),纵隔淋巴结及胸膜转移。患者口服吉非替尼20个月后病情进展,随后改用奥希替尼治疗,肺部病变明显减少。一年后(2017 年 2 月),它再次取得进展。血浆基因检测发现3个EGFR突变同时阳性:21外显子突变(丰度6.0%)、20外显子突变(丰度1.7%)和20外显子顺式突变(丰富度 0.6%)。
由于以往的研究表明抗血管生成药物+TKI可以延长PFS(无进展生存时间),因此患者接受了奥希替尼联合贝伐单抗治疗。6个月(2个周期)后,肺部病变减少,胸闷气短症状明显缓解。奥希替尼联合贝伐克疗法治疗奥希替尼耐药显着抑制肿瘤进展。4个治疗周期(3个月)后,患者再次进展,在奥希替尼联合贝伐卡加布加替尼的基础上,患者达到部分缓解(PR)。整个靶向治疗过程中未发生严重不良反应。
图 E 显示奥希替尼治疗 1 年后的疾病进展,图 F 显示添加贝伐单抗后的缓解。
2.贝伐单抗联合TKI的PFS达到8个月,是奥希替尼耐药后史上最长的无进展时间!
42岁女性晚期肺腺癌骨脑转移,阳性,2014年2月接受厄洛替尼治疗,耐药后化疗。当疾病再次进展时,组织NGS检测出二次突变,第三代TKI奥希替尼治疗近三年。2018年4月病情进展,组织和NGS检测发现存在3个突变,均为反式( )。患者开始“1代+3代”吉非替尼联合奥希替尼治疗,2个月后因对吉非替尼不耐受转为厄洛替尼联合奥希替尼治疗。贝伐单抗7.5mg/kg/3周每次加到第1代和第3代。接受TKI联合治疗后,咳嗽、呼吸困难症状明显缓解,肺部病变影像学评价也达到PR,肺泡间隔变薄和胸腔积液减少。液体活检仅在联合治疗 4 个月后呈阳性。三药联合治疗实现了 8 个月的 PFS。
患者使用1代+3代耐药,加用贝伐单抗,通过增加瘤内药物摄入量提高疗效,成功实现奥希替尼耐药后的PFS至8个月。这也是迄今为止文献报道的奥希替尼耐药后最长的 PFS。
3. 抗血管生成药物对抗EGFR耐药的机制
既往研究表明,EGFR-TKI耐药后,肿瘤细胞对EGFR信号的依赖性降低,VEGF(血管内皮生长因子)水平升高。因此,认为VEGF依赖的肿瘤生长是EGFR的耐药机制之一(如下图)。贝伐单抗是临床上常用的 VEGF 单克隆抗体。与EGFR-TKI联合使用时,可同时作用于不同的靶点(VEGF和EGFR)。对EGFR-TKI耐药患者可增加抗肿瘤疗效。
在一项细胞研究中,图 B 显示,与对照相比,厄洛替尼治疗 EGFR 突变细胞群 4 天降低了肿瘤 VEGF 蛋白的表达,但在第 68 天,VEGF 再次增加。随后的厄洛替尼 vs 厄洛替尼 + 贝伐单抗治疗成功地在第 75 天将联合组中的 VEGF 水平降至最低。

目前,也有多项EGFR-TKI联合抗血管药物(贝伐单抗或国产阿帕替尼)的研究成果公布,在TKI耐药的后线治疗中显示出稳定控制率(DCR)。请参见下表。
总结
EGFR/ALK靶向耐药后,肿瘤进展早期的血管增生可能会阻碍TKI的有效分布并杀死癌细胞。这时可以加入抗血管生成药物“修饰”肿瘤血管,使EGFR/ALK靶向药物顺利进入肿瘤完成任务。对于不想化疗的患者,这是一种治疗选择。
参考:
1. 等。to 迷失在 ALK Lung .2019
2. Jing Zhao et al, of EGFR of , , and cis- by, , and : a case , 2018.9.7.
3. 顺路等人。肺 EGFR //- 到 - 和 - EGFR TKIs.2019
4. K.贾恩。with anti- : 一个新的 for
.2001
5. 等。VEGF- 到 EGFR- 中。2017
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话