欢迎光临吉康旅!
每年年底,肺癌同仁都期待着广东省人民医院吴一龙教授为肺癌领域的进展做个年终盘点。12月17日在广州举行的“肺癌年会”上,吴一龙教授盘点了2020年肺癌的重大事件,包括改变临床实践的重大研究(包括FDA和CDE批准的新药等重大研究) ,酝酿新突破的研究,小河菜路的研究。
改变临床实践的研究
1
EGFR通路最重要的研究
2020年发表的最重要的EGFR通路研究,比较了奥希替尼与安慰剂在完全肿瘤切除治疗后对具有敏感EGFR突变的IB、II和IIIA期非小细胞肺癌()患者的辅助治疗。今年发表在《新英格兰医学杂志》(NEJM)上的结果表明,第三代 EGFR-TKI 作为辅助治疗显着延长了中位无病生存期(DFS),并将疾病复发或死亡的风险降低了 83%(HR= 0.17)。
此外,今年第一代EGFR-TKI辅助治疗的研究发表了OS结果,虽然没有达到统计学意义,但辅助靶向组的OS数据延长了12.7个月(7< @5.5 vs 62.8 个月),死亡风险降低 8%(HR=0.92),该研究结果已被 JCO 期刊接受。该研究比较了头对头的佐剂靶向和化疗,纳入的患者为 ll-IIIA 期患者,不包括 IB 期患者。
此外,该研究将于明年一月在世界肺癌大会上发表。比较埃克替尼和化疗辅助治疗 ll~IIIA 期,目前的中位 DFS 数据分别为 47.0 和 22.1 个月。
然而,研究结果也面临许多质疑。我们需要解决以下关键问题:①辅助化疗起什么作用?吴一龙教授指出,化疗与靶向的头对头比较结果显示,辅助化疗组的DFS差,OS结果与辅助靶向组相近。此外,在该研究中,未接受辅助化疗的患者比接受辅助化疗的患者具有更好的生存结果。辅助化疗的标准于2009年制定,十多年后,辅助化疗的真正作用有待进一步探索。2021 年第一版 NCCN 指南建议 IB 至 IIIB 期 EGFR 阳性患者对奥希替尼进行辅助靶向治疗。适用患者的定语表达为“接受过辅助化疗或不适合含铂双药辅助化疗”,即不接受辅助化疗。接受辅助化疗的患者也可以接受辅助靶向治疗;
② 辅助靶向治疗应该选择第一代EGFR-TKI还是第三代药物?正在准备启动第一代 EGFR-TKI 和第三代 TKI 的头对头比较研究。
2
-743 改变了胸膜间皮瘤的临床实践
在 2020 年世界肺癌大会在线主席座谈会上公布的 III-743 期结果显示,在未经治疗的不可切除的恶性胸膜间皮瘤中,与标准化疗相比,纳武单抗/易普利姆玛联合疗法显着延长了总生存期(18.1 个月 vs 14.1 个月),并降低 26% 的死亡风险(HR=0.74; P=0.@ >002)。基于以上发现,今年 10 月 2 日近日,美国食品药品监督管理局(FDA)批准了纳武利尤单抗/易普利姆玛双重免疫疗法,用于无法手术切除的成人恶性胸膜间皮瘤的一线治疗,这是16年来首个获批治疗间皮瘤的药物疗法。

3
结论:LUNG ART 证明 PORT 对 IIIA N2 患者无益
IIIA N2 期患者术后辅助放疗的益处一直存在争议。在 2020 年 ESMO 虚拟会议上公布的 Lung ART(IFCT-0503,UK NCRI,SAKK)结果显示,术后放疗(PORT)未能显着改善 IIIA N2 期患者 DFS 的主要终点,辅助放疗增加死亡率并增加IIIA N2 患者不推荐术后辅助放疗。
4
罕见突变:2020 年改变临床实践的重要研究
在MET、RET融合、KRAS G12C等相关罕见突变领域,2020年将有多个药物上市。在今年5月获得FDA批准的MET领域,ORR在 mono-1 研究中,初治患者为 68%(Wolf 等人 NEJM 2020.6@>;研究的中位 PFS 为 8.3 个月(Paik 等人 NEJM 2020.6 @>;以上结果证明MET患者可以接受小分子靶向药物治疗。
有 RET 抑制剂于 2020 年获得 FDA 批准。-001 研究,中位 PFS 为 10.9@>5 个月(等 NEJM 2020.6@>;研究数据(2020 ASCO 9515)@ >. 这些结果表明 RET 已成为标准目标。
在 KRAS G12C 领域,批准基于 100 项研究(Hong 等 NEJM 2020.6@>,队列中 59 名患者的 ORR 为 32.2%,中位 PFS 0.9@>3 个月),为未来的 KRAS 抑制剂研究树立了标杆。目前,KRAS领域的研究较多。
5
2020年临床研究锦上添花
ALK抑制剂的研发是相互追逐的,更不要说让步了。第三代ALK-TKI劳拉替尼、第二代药物恩沙替尼和第二代药物恩沙替尼均取得了良好的效果;今年5月发表在Ann上的一项研究表明,艾乐替尼的5年生存率达到了62.5%(al. Ann)。
在EGFR领域,锦上添花的是国产EGFR抑制剂阿美替尼的II期临床研究。3月18日,CDE批准阿美替尼+二线治疗。
在化疗领域,该研究评估了培美曲塞联合顺铂对比长春瑞滨联合顺铂作为II-III期非鳞状细胞癌患者辅助化疗的疗效,发现含培美曲塞的方案毒性较小。 J Clin . 2020). 胶束紫杉醇和仿制药紫杉醇的头对头 III 期研究导致细胞毒性药物开发的新突破(Shi 等人 Ann 2020.6@>.
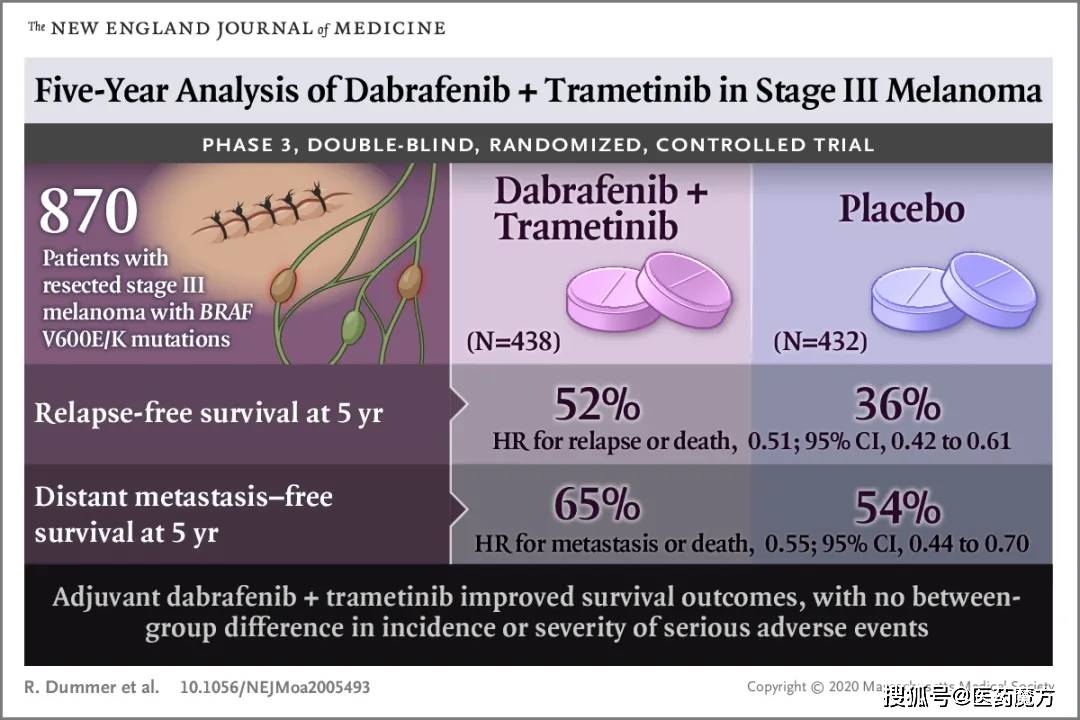
在EGFR敏感突变的联合治疗方面,今年5月,根据研究结果,FDA批准了雷莫芦单抗+厄洛替尼的适应症,用于一线治疗转移性EGFR突变。
-227为PD-L1≥1%且无EGFR或ALK突变的转移性患者提供一线免化疗方案,-9LA提供双免疫联合少化疗方案。根据研究结果, 被批准作为单药用于晚期 PD-L1 表达的一线治疗。国内PD-1/L1抑制剂研发如火如荼,但研究设计以Me-too设计为主,研究缺乏创新性研究设计。
研究酝酿新突破
在新辅助免疫治疗方面,多项单药和联合用药研究正在进行中,前景良好,但目前的研究结果并不能改变临床实践。
cMET 扩增序列研究的困难之一是它非常复杂,很难确定什么是可用的。
在HER-2突变转移患者中,研究中ADC药物的ORR为61.9%,中位PFS为14个月(2020 ASCO)。
对于 EGFR 外显子 20 插入,尽管有众多研发药物,但只有 EGFR/HER2 抑制剂 TAK-788 和 EGFR-MET 双特异性抗体获得 FDA 突破性治疗指定。
中国学者开展的TKI联合放疗治疗寡转移灶的研究(2020 ASCO Abs 9508),PFS和OS分别为20.2个月和25.5个月,分别差距较小,原因不明。
对于无法切除的局部晚期患者,放化疗前可以使用免疫治疗药物吗?-799研究证明,免疫提升的功效是可以接受的,毒性是可以接受的(2020 ASCO Abs 9008).
小河才录研究
为了克服EGFR耐药机制,研究人员设计了第一代EGFR-TKI联合第三代EGFR-TKI(2020 ASCO Abs 9507),被称为“开脑洞”)的研究。吴一龙教授,结果显示疾病控制率100%。
新靶点出现,在II期研究(2020 ASCO Abs 9503)中,单克隆抗体联合免疫检查点抑制剂一线治疗PD-L1阳性晚期取得了良好效果,奠定了基础后续研究。
该研究初步证明了在 T 细胞中编辑多个基因用于免疫治疗的可行性和安全性,但研究设计需要改进以达到更有效和非脱靶的治疗效果(Lu Y, et al. NAT Med 202 0)。
总结
2020年的研究进展将为早期EGFR突变治疗策略带来改变:
- 辅助治疗有四种选择:
①奥希替尼辅助治疗;
②吉非替尼辅助治疗;
③辅助化疗后使用奥希替尼;
④辅助化疗
- 可以使用低毒性培美曲塞方案。
- 完全 N2 切除后不需要辅助放疗。
2020-2021年晚期患者治疗概述:
红色:今年获批;斜体:仅在中国获批
同类型肺癌患者的选择越来越多。如何为患者选择最佳方案?今年年初,吴一龙教授提出了基于价值的医疗评分,包括四个维度:有效性(PFS/OS、后续治疗)、安全性(治疗相关的SAE和剂量调整)、生活质量、补偿(无论是医保覆盖还是其他补偿方式等),四者的有机结合可以最大限度地提高患者的利益。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话